Получение рекомбинантного
белка β-субъединицы Н,К-АТФазы с флуорисцентным
белком YFР
Турдикулова Шахло Уткуровна,
кандидат биологических наук, доцент
кафедры «Микробиологии и биотехнологии» Национального Университета Узбекистана.
Желудочная Н,К-АТФаза – фермент, ответственный за секрецию
кислоты париетальными клетками эпителия желудка, принцип работы насоса
заключается в осуществлении обмена протона на ион калия. Н,К-АТФаза состоит из двух субъединиц – каталитической
α-субъединицы и вспомогательной β-субъединицы, имеющей семь сайтов гликозилирования [Geering, 2001; Vagin et al., 2007]. Н,К-АТФаза в покое располагается в
тубуловезикулярных элементах париетальных клеток и
передислоцируется в секреторные каналикулы апикальной
мембраны в ответ на стимуляцию кислотообразования. Такое рециркулирование помпы
между внутриклеточными тубуловезикулами и апикальной мембраной
несомненно является ключевым моментом в регуляции кислотообразования [Sachs et al.,
2000; Smolka et al., 1983].
Необходимость использования YFP-меченых
белков в данном исследовании, объясняется
использованием конфокальной микроскопией для выявления местоположения белка в
клеточной культуре. Применение методов иммуногистохимии
требует фиксирования исследуемого материала, в то время как за YFP мечеными
белками можно наблюдать непосредственно в живых клетках. Еще одним
преимуществом можно назвать удобство получения клонов клеток стабильно
экспрессирующих рекомбинантный белок. Для этих целей
нами была получена рекомбинантная векторная молекула,
содержащая ген β субъединицы Н.К-АТФазы
с присоединенным флуоресцентным маркером. В качестве исходной векторной
конструкции использовалась плазмида pEYFP-C1 (BD Bioscience Clontech). Это
челночный вектор, используемый для клонирования в клетках E.coli и клетках млекопитающих.
Векторная молекула содержит ген, кодирующий флуоресцентный белок Yellow Fluorescent Protein (YFP),
встраивание рекомбинантного гена сразу после YFP
части позволяет получать fusion белок, содержащий YFP
маркер на C-конце белковой молекулы
пригодный для исследований in vivo.
В качестве источника гена β
субъединицы Н.К-АТФазы использовали вектор рсDNA3(+)β [Lambrecht et al., 2000], кодирующий
аминокислотную последовательность β-субъединицы
Н,К-АТФазы кролика [Reuben et
al., 1990] - (Genbank accession number M35544). Ген был клонирован в экспрессирующий вектор pEYFP-C1
путем рестрикции и лигирования в
множественный сайт рестрикции вектора, находящийся между YFP частью и стоп
кодоном по сайтам рестрикции BglII и BamHI. Таким образом получили вектор pEYFP-β, который кодировал гибридный белок
флуоресцентного белка YFP,
присоединенного к N-концу
белка β-субъединицы.
Полученная конструкция была трансформирована и клонирована в клетках E.coli на
селективной среде, содержащей канамицин. Из полученных
клонов выделяли плазмидную ДНК и проверяли путем
контрольной рестрикции рестриктазами BglII и BamHI на наличие
вставки. Векторные молекулы, содержащие вставку, были секвенированы
на наличие вставки, ее местоположения, правильной ориентации и отсутствия
возможных сдвигов рамок считывания. Нуклеотидная последовательность β-субъединицы сравнивалась с
опубликованной в базе данных NCBI
последовательностью гена β-субъединицы
Н,К-АТФазы кролика при помощи программы Vector NTI.
Только векторные молекулы, содержащие полноразмерный ген β-субъединицы Н,К-АТФазы без сдвигов рамки
считывая и нуклеотидных замен или повторов использовались для последующей
трансформации в клетки линии LLC-PK1.
Вектор был трансфецирован в клетки линии LLCPK-1, затем, путем
поддержания концентрации 1,0 мг/мл селективного маркера G418 в течение 50-60
дней были отобраны и получены линии клеток стабильно экспрессирующие
белок YFP-β, то есть в которых ген YFP-β оказался в клеточном геноме, клоны отбирались по устойчивости к
селективной среде и флуоресцентному свечению. При получении линии клеток
стабильно экспрессирующей белок процесс отбора клонов
представляет довольно сложную процедуру, выживаемость клеток в присутствии
селективного давления не всегда соответствует экспрессии нужного белка, поэтому
каждый клон при достижении определенного количества клеток необходимо проверять
при помощи иммуноблоттинга на наличие белка, это
вызывает определенные неудобства в связи с необходимостью отбора всех имеющихся
клонов на первичной селективной среде и ожидания роста клеток, прямо
пропорционального количеству исходных клеток, так как каждый клон является
потомством одной клетки, то вначале они растут довольно медленно. Использование
YFP-меченного белка упрощает эту процедуру, позволяя отбирать только клоны с
наличием флуоресцентного свечения. Таким образом, в результате селекции было
отобрано 16 клонов. Каждый клон был исследован на наличие, правильный вес и
достаточное количество белка путем иммуноблот
анализа, а также при помощи конфокальной микроскопии проанализировано
местоположение полученного белка в клетках. По этим характеристикам было
отобрано два клона с оптимальной экспрессией правильно сформированного белка
для дальнейших экспериментов. На рисунке 1 представлены данные иммуноблотинга и конфокальной микроскопии белка YFP-β в клетках LLC-PK1. Как видно из данных иммуноблотинга при помощи антител против β-субъединицы в клеточном лизате белок проявлялся в виде двух пятен одного весом 80-100 кДа и другого ~75 кДа, что согласно теории гликозилирования соответствует
зрелой комплексно гликозилированной форме белка –
верхнее пятно и высокоманнозной форме белка,
находящейся на стадии созревания. Конфокальная микроскопия показала присутствие
белка на апикальной мембране клеток LLC-PK1.
Кроме того, рекомбинантный
белок β-субъединицу
Н,К-АТФазы проверяли на наличие гликозилирования путем обработки ферментами гликозидазами и проверки веса белка путем гель
электрофореза на SDS PAGE и последущим
иммуноблот анализом.
Характеристика
гликозилированных форм YFP-β
экспрессируемых в клеточной линии LLC-PK1.
A 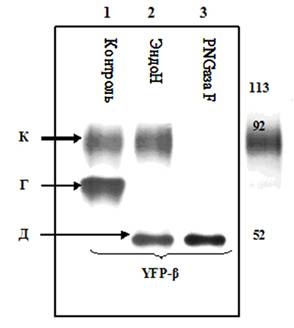 B
B
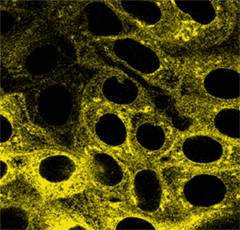
Рис.1.
А. Иммуноблот анализ YFP-β белка экспрессированного в
клетках LLC-PK1 и эффект обработки
различными
гликозидазами. К –
комплексно гликозилированная форма; Г – гибридная
форма; Д – дегликозилированная форма.
В. Конфокальная
микроскопия клеток LLC-PK1, экспрессирующих YFP-β.
Химерный белок YFP-β-субъединица
Н,К-АТФазы обнаруживался в клеточном лизате LLC-PK1 в виде двух пятен,
одного в районе 80-100 кДа и другого соответствовавшего
~75 кДа (Рис.1, линия 1). Для анализа степени и форм
гликозилирования экспрессируемого белка проводили
обработку белков несколькими ферментами. После обработки клеточного
лизата ферментом PNGase F –
полностью удаляющим гликаны, ни одна из полос 80-100 кДа и 75 кДа не проявлялась, в то
время как появлялось одно пятно в районе ~55 кДа
соответствующее по весу дегликозилированной форме YFP-β (линия 3). Тот же самый продукт образовался
при обработке клеточного лизата
ферментом эндогликозидазой Н (EndoH),
однако при этом исчезала только нижняя полоса, а верхняя полоса,
по-прежнему, проявлялась на Вестерн Блоте (полоса 2). Известно, что EndoH способна воздействовать только на высокоманнозную
или гибридную формы гликопротеина, в то время, как комплексная форма имеет
устойчивость к воздействию этого фермента. Таким образом, полоса
соответствующая 80-100 кДа представляет собой
комплексно гликозилированную фракцию YFP-β. EndoH чувствительная, соответствующая 75 кДа фракция является высокоманозной
формой YFP-β.
В результате проведенных
экспериментов получена рекомбинантная ДНК гибридного
белка YFP-β субъединицы Н,К-АТФазы,
которая была экспрессирована в клеточной линии LLC-PK-1. Белок имеет
правильную конформационную структуру, соответствующий
молекулярный вес и проходит все стадии гликозилирования.
Литература
1.
Geering, K. The
functional role of beta subunits in oligomeric P-type
ATPases.// J Bioenerg Biomembr. -2001.-Vol 33;-№ 5.-
P.425-438.
2.
Lambrecht, N., K.
Munson, O. Vagin, et al. Comparison of covalent with
reversible inhibitor binding sites of the gastric H,K-ATPase
by site-directed mutagenesis.// J Biol Chem.
-2000.-Vol 275;-№ 6.- P.4041-4048.
3.
Reuben, M. A., L. S. Lasater
and G. Sachs. Characterization of a beta subunit of the gastric H+/K(+)-transporting
ATPase.// Proc Natl Acad Sci U S A. -1990.-Vol 87;-№
17.- P.6767-6771.
4.
Sachs, G., J. M. Shin, K. Munson, et al. Review
article: the control of gastric acid and Helicobacter pylori eradication.//
Aliment Pharmacol Ther.
-2000.-Vol 14;-№ 11.- P.1383-1401.
5.
Smolka, A., H.
F. Helander and G. Sachs. Monoclonal antibodies
against gastric H+ + K+ ATPase.// Am J Physiol.
-1983.-Vol 245;-№ 4.- P.G589-596.
6.
Vagin, O., S. Turdikulova and E. Tokhtaeva.
Polarized membrane distribution of potassium-dependent ion pumps in epithelial
cells: different roles of the N-glycans of their beta
subunits.// Cell Biochem Biophys.
-2007.-Vol 47;-№ 3.- P.376-391.
Поступила в редакцию 30.06.2008 г.