Анализ изменений
композиции белков сыучжного сыра с чеддеризацией и плавлением сырной массы на ключевых стадиях
его производства
Просеков Александр Юрьевич,
доктор технических наук,
профессор,
Ли Чэн,
master degree, vice-professor,
Sichuan Agricultural University,
Чжэн Цзя,
аспирант,
Железнов Андрей Иванович,
аспирант.
| Вот тут ГДЗ по русскому языку 7 класс Ладыженская вот тут www.euroki.org |
Кемеровский
технологический институт пищевой промышленности.
купить дримлаш drmlsh.ru Как взять кредит на покупку бизнеса издержки и риск при покупке малого бизнеса cashflow-invest.ru
Известно,
что белковая структура молока при производстве сычужного сыра претерпевает
определенные изменения, как в количественном, так и в качественном отношении
[1]. По белковой композиции продукта можно судить о его полезности, насыщенности
полезными веществами и, что немаловажно – о переносимости его людьми с аллергическими
реакциями на определенные виды белка. Актуальную научную проблему также
составляет изучение процессов сохранения в сыре молочных белков при отделении
сыворотки и фракционного состава белка на ключевых стадиях выработки сыра после
процесса чеддеризации, в ходе которого коренным образом изменяется его
реология.
Общие
количественные и качественные изменения белка целесообразно рассматривать,
используя методику электрофореза в 12,5% полиакриламидном геле по способу
Лэммли. Для сравнительной оценки относительной электрофоретической подвижности
белков применен маркер (белок с известной молекулярной массой) производства Bio-Rad, каталожный номер BR-161-0318. Окрашивание производилось с использованием
кумасси G250
Blue
без применения трихлоруксусной кислоты (рис. 1).
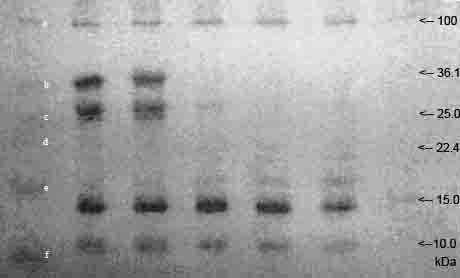
Рис. 1. Разделение белка в 12,5%
полиакриламидном геле.
Первый трек слева – белковый маркер.
Вторым следует сырое коровье молоко, в котором наблюдаются крупные фракции
казеина, основного белка молока. Прочие белки относятся к сывороточным
и они также в той или иной степени представлены в данном треке, из них можно
выделить бета-лактоглобулин и альфа-лактоальбумин (рис. 2).
Третий трек - молоко после
созревания, изменений по сравнению с сырым молоком немного, т.к. активность
лактобактерий в недостаточной степени высока. Однако,
молекулярный спектр в данный момент расширился (рис. 3).
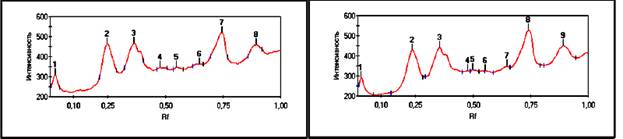
Рис. 2, 3. Хроматограмма
белков коровьего молока в ПААГ.
Четвертым треком представлен белок в
сырном сгустке после свертывания, и, как видно, две крупные фракции казеинов почти
полностью пропали (рис. 4). Пятый трек отражает белковые изменения в сыре после
отделения сыворотки, вышеобозначенные фракции казеина окончательно исчезли, что
также говорит о переходе существенной части белков молока в сыворотку (рис. 5).
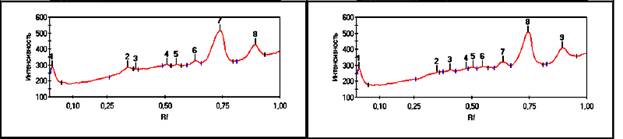
Рис. 5, 6. Хроматограмма
белков промежуточного продукта.
На шестом треке виден сыр после
окончания процесса чеддеризации, легко заметить, что количественный белковый
состав приблизительно однороден с предыдущим треком, однако в качественном отношении
видов белка стало существенно больше (рис. 7).
Последний трек иллюстрирует белок в сыре
после плавления сырной массы и непродолжительной посолки (рис. 8). Как видно,
часть белка денатурировала вследствие воздействия высокой температуры в
процессе термической обработки, произошел выход свободных аминокислот, что в
конечном итоге, повлияло на вкусовые качества сыра.
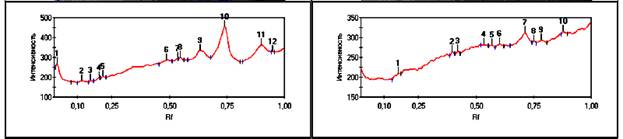
Рис. 7, 8. Хроматограмма
белков конечного продукта.
Итак, молочный белок представлен,
главным образом, глобулярным белком казеином (самая заметная и отчетливо
видимая зона на электрофореграмме). Также можно выделить фракции альбуминов и
некоторые иммуноглобулины. При ферментации молока (скисании), под действием
закваски казеин теряет кальций, который связывается образующейся из лактозы
молочной кислотой и выпадает в виде творога. Частично оседают и остальные
белки, но существенно в меньших количествах. Отделенная сыворотка отводит из
сыра некоторое количество полезных минералов, пептидов, аминокислот и водорастворимых
белков.
К данной белковой массе добавляются протеины
разделенных молочнокислых бактерий. Относительный качественный состав белков
увеличивается. Далее следует ферментация под действием сычужных ферментов.
Фактически, добавляются ферменты класса протеаз (химотрипсин, пепсин, трипсин),
которые естественным образом изменяют картину белкового спектра до
ферментирования своим присутствием. Эти активные ферменты начинают медленно
разделять длинные цепи казеина и прочих белков на части меньшего размера, тем самым разнообразя
белковый спектр.
Итак,
цель исследования достигнута – продемонстрированы изменения белкового состава
материала при выработке сыра. В SDS-PAGE электрофорезе
возможно говорить лишь о субъединицах с определенной молекулярной массой. Для
точного определения типа белков исследование в будущем может быть расширено для
использования метода гель-проникающей хроматографии и
калибровкой по белковым маркерам ВЭЖХ.
Литература
1.
Шилер
Г.Г. Справочник технолога молочного производства: Технология и рецептуры. Т.3.
Сыры: Справочник. // Г.Г. Шиллер. - СПб.: ГИОРД, 2001. - 512 с.
2.
Остерман Л.А. Методы исследования белков
и нуклеиновых кислот: электрофорез и ультрациентрифугирование (практическое
пособие). // Л.А. Остерман. - М.: Наука, 1981. - 288 с.
3.
Девени
Т. Аминокислоты, пептиды и белки. Пер. с английского А.Н. Маца. / Т. Девени, Я. Гергей. - М.: Мир, 1976. - 360 с.
4.
Zdenek D. Electrophoresis: Survey of Techniques and Applications: Applications
Pt. B (Journal of Chromatography Library). // D. Zdenek.
- Elsevier, 1982. - 476 p.
5.
Hames B.D. Gel Electrophoresis of Proteins: A Practical Approach. // B.D. Hames. -
Поступила в редакцию 16.03.2009 г.