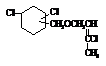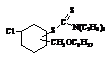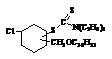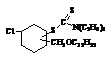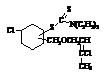Синтез новых азот- и
серосодержащих органических соединений на основе эфиров 1-винил-3,4-(хлор,
алкоксиметил) циклогексанов и 2,6-дихлор-5-оксогексена-2 и проведение их
исследований
Байрамов Гияс Ильяс оглы,
кандидат химических наук,
преподаватель кафедры «Экологической химии»
Бакинского государственного
университета.
На основе 2-хлор алкоксиметиловый и
2,6–дихлор-5-оксогексена-2 эфиров получено1-винил-3,4-(хлор, алкоксиметил)
циклогексанов и 1-винил-3,4-(хлор, 2-хлор-5-оксогексен-2) циклогексан. На основе
полученных этих соединений синтезированы 4 новых азот и серосодержащих
органических соединений, было приведено их исследование в качестве инсектицидов
и ингибиторов. При исследовании проявились активные свойства как инсектицидов
(соед. IV-VIII), так и ингибиторов коррозии (соед. V-VIII)
в кислых средах (сероводород содержащих и не содержащих).
Синтез
проведен известными методами [1-3] в 3 этапа. На I этапе получен a-хлорметил
алкоксиловых эфиров
![]()
где, ![]()
На
II
этапе на основании a-хлорметил
алкоксиловых эфиров получены 1-винил-3,4-(хлор, алкоксиметил) циклогексанов и
1-винил-3,4(хлор, 2-хлор-5-оксогексен--2) циклогексан.

На
III
этапе синтезированы азот- и серосодержащие органические соединения
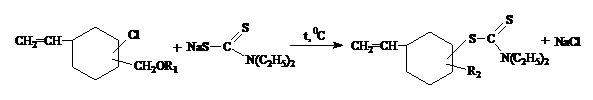
где,
![]()
![]()
Синтезированные
органические соединения I-VIII и их физико-химические константы и
данные элементного анализа приведены в таблице 1.
Таблица 1.
Физико-химические константы и элементный анализ
синтезированных соединений I-VIII.
|
№
соед. |
Соединение |
Выход. % |
Т.
Кип 0С
(мм.пт.ст.) |
|
|
|
Брутто
формула |
Мол. Вес |
Элементный
анализ |
||||||||
|
Найдено
% |
Вычислено
% |
||||||||||||||||
|
Най-дено |
Вычис-лено |
C |
H |
Cl |
N |
C |
H |
Cl |
N |
||||||||
|
I |
|
89 |
161-163 (3) |
0.9160 |
1.4591 |
85.51 |
85,09 |
C17H31Ocl |
286,5 |
71,53 |
11,14 |
12,69 |
- |
71.20 |
10.83 |
12.42 |
- |
|
II |
|
88,5 |
173-175 (3) |
0.9060 |
1.4548 |
94.56 |
94.38 |
C19H35Ocl |
314,5 |
73,05 |
10,16 |
11,36 |
- |
72.49 |
9.85 |
11.28 |
- |
|
III |
|
88,7 |
184-185 (3) |
0,9292 |
1.4587 |
99.53 |
99.43 |
C21H39Ocl |
342,5 |
74,82 |
10,68 |
10,78 |
- |
74,45 |
10,34 |
10.49 |
- |
|
IV |
|
85,9 |
142-144 (3) |
1,0480 |
1,4839 |
71,64 |
70,84 |
C13H20Ocl2 |
263 |
59,58 |
7,84 |
27,14 |
- |
59,31 |
7,6 |
26,99 |
- |
|
V |
|
90,2 |
148-150 (3) |
0,9345 |
1,4871 |
122,79 |
122,65 |
C22H41ONS2 |
399 |
66,46 |
10,47 |
- |
3,61 |
66,16 |
10,27 |
- |
3,5 |
|
VI |
|
89,8 |
159-161 (1) |
0,9317 |
1,4896 |
131,97 |
131,94 |
C24H45ON S2 |
427 |
67,81 |
10,94 |
- |
3,52 |
67,45 |
10,54 |
- |
3,27 |
|
VII |
|
90 |
170-171 (1) |
0,9350 |
1,4924 |
141,27 |
141,23 |
C26H49ON S2 |
455 |
68,91 |
11,01 |
- |
3,29 |
68,57 |
10,77 |
- |
3,08 |
|
VIII |
|
88,9 |
156-158 (3) |
1,0750 |
1,5002 |
102,76 |
102,55 |
C18H30Ocl N S2 |
375,5 |
57,88 |
8,03 |
9,67 |
3,96 |
57,52 |
7,98 |
9,45 |
3,73 |
Структура
соединений V-VIII подтверждается их ИК, ПМР и
масс-спектрами.
В
масс–спектре соединений I-VIII молекулярные ионы имеют массы
соответственно 286,5; 314,5; 342,5; 263; 399; 427; 455; 375,5 равные
молекулярным массам соединений. В ИК спектре этих соединений проявляются полосы
1056-1080, 1380, 1450, 2800-3000, 1440, 2850, 3080, 1647, 990,
В
спектре ПМР этих соединений имеются сигналы метиленовых групп кольца (широкий,
интенсивный мультиплет в области 1,41-
Было
проведено исследование синтезированных соединений IV-VIII в качестве инсектицидов в борьбе с
ложной щитовкой и тлями, хорошие результаты в качестве начального действия
инсектицидных препаратов показали соед. IV-VIII. Соед.V под названием «1-винил-3(4) октилоксиметил-4(3)-(диэтиламино
тиокарбонилтио) циклогексан, обладает инсектицидной активностью» по формуле

Соединение
защищено авторским свидетельством СССР за № 1540230,
В
качестве эталона был взят широко известный инсектицид - карбафос.
Результаты
испытания приводятся в таблице 2.
Таблица 2.
Влияние соединений IV-VIII на гибель персиковой тли на тепличных огурцах и помидорах.
|
№ соединения |
Концентрация препарата,
% |
Первая неделя, % гибели тли |
Вторая неделя, % гибели тли |
Третья неделя, % гибели тли |
Четвертая неделя, (один месяц) % гибели тли |
|
IV |
0,0025 0,025 |
98 99 |
100 100 |
100 100 |
100 100 |
|
V |
0,0025 0,025 |
81 88 |
90 99 |
99 100 |
100 100 |
|
VI |
0,0025 0,025 |
86 89 |
96 99 |
99 100 |
100 100 |
|
VII |
0,0025 0,025 |
89 95 |
99 100 |
100 100 |
100 100 |
|
VIII |
0,0025 0,025 |
99 100 |
100 100 |
100 100 |
100 100 |
|
Аналог соед. А |
0,0025 0,025 0,05 |
51 70 80 |
69,5 81 86 |
83 89 100 |
92 96 100 |
|
Контроль |
- |
- |
- |
- |
- |
|
ОП-10 эмульгатор |
2,5×10-4 |
- |
- |
- |
- |
Таблица 3.
Влияние соединений IV-VIII на щитовку декоративного растения «кактус».
|
№ соединения |
Концентрация препарата,
% |
Первая неделя, % гибели |
Вторая неделя, % гибели |
Третья неделя, % гибели |
Четвертая неделя, (один месяц) % гибели |
|
IV |
0,0025 0,025 |
98 100 |
100 100 |
100 100 |
100 100 |
|
V |
0,0025 0,025 |
66 72,5 |
75 82,5 |
93,7 100 |
100 100 |
|
VI |
0,0025 0,025 |
85 88 |
98 100 |
100 100 |
100 100 |
|
VII |
0,0025 0,025 |
96 98 |
99 100 |
100 100 |
100 100 |
|
VIII |
0,0025 0,025 |
100 100 |
100 100 |
100 100 |
100 100 |
|
Аналог соед. А |
0,0025 0,025 |
33,7 41,2 |
50 59,5 |
58,5 67 |
68,7 83,7 |
|
Контроль |
- |
- |
- |
- |
- |
|
ОП-10 эмульгатор |
2,5×10-4 |
- |
- |
- |
- |
Испытания
показали, что использование соединений IV и VIII в качестве инсектицидных препаратов в
конце первой и второй недели приводит к полному уничтожению вредителей, не
оказывая при этом влияния на цвет, рост и развитие самих растений. Испытание
соединений IV
и VIII
в качестве действующего начала инсектицидного препарата проведено на тепличных
помидорах, огурцах, против персиковой тли, а также на декоративном растении
«кактус» против ложной щитовки в сравнении с ближайшим аналогом (соед. А)
Опрыскивание
проведено ручным опрыскивателем, обработка заключалась в однократном опрыскивании
водным раствором препарата определенной концентрации. В качестве эмульгатора
использовано ОП-10 в количестве 0,25 % от веса действующего начала.
Испытания
проведены при 37-390С и абсолютной влажности 70-75 %. Каждый раз выделено
10 модельных растений, на которых подсчитывалась степень зараженности
вредителями до и после обработки через определенные промежутки времени.
Преимущество
испытанных препаратов (соед. IV
– VIII)
заключается еще и в невысокой токсичности их по отношению к теплокровным. По
сравнению с соед. А
определение
токсичности соед. IV
– VIII
по отношению к белым мышам показало, что препарат на их основе (концентрация
2,5 ×10-3
мас. %) является в два раза менее токсичным чем ближайший аналог (соед. А).
Было
проведено исследование синтезированных соединений V – VIII также в качестве ингибиторов коррозии
стального оборудования нефтедобывающей, нефтеперерабатывающий и нефтехимической
промышленности. Исследование было проведено в двухфазных системах, имитирующих
кислые среды (сероводородосодержащие и не содержащие).
Оценку
ингибирующей эффективности соединений проводили гравиметрическим методом [5] по потере
массы металла.
![]()
где: к – скорость коррозии (г/м2×ч);
Р1 – вес образца до начала опыта
(г);
Р2 – вес образца после опыта (г);
S
– площадь поверхности образца (м2);
t
- время проведения опыта (ч)
![]()
где:
Z
– эффект защиты;
к0, кинг.- скорость
коррозии в отсутствие и присутствии ингибитора.
![]()
где
g - коэффициент
торможения.
Коэффициент
торможения «g»-определяется
отношением скоростей коррозии без ингибитора и при наличии ингибитора.
В
таблице 4 приводится ингибирующая эффективность соединений V – VIII. Как видно из данных, приведенных в этой
таблице, величина защитного эффекта соединений зависит не только от природы
функциональных групп, но и от наличия или отсутствия сероводорода в
коррозионной среде.
Таблица 4
Исследование эффекта ингибирования в условиях имитирующих
условия сероводородосодержащих нефтяных и газоконденсатных скважин.
|
№ соед. |
Ингибитор |
Концентрация ингибитора, мг/л |
0,04 % CH3COOH +октан (1:1) |
3%
NaCl +нефть (7:1) |
||||
|
H2S 1000 мг/л |
H2S 500 мг/л |
|||||||
|
Скорость коррозии, г/м2×ч |
Степень защиты, |
Коэффициент торможения,
g |
Скорость коррозии, г/м2×ч |
Степень защиты, |
Коэффициент торможения,
g |
|||
|
|
Без ингибитора |
|
|
|
|
|
|
|
|
V |
|
100 200 |
0,25 0,05 |
95 99 |
20 100 |
0,14 0,08 |
25,3 97,33 |
|
|
VI |
|
100 200 |
0,03 0,02 |
99,4 99,6 |
166 250 |
0,07 0,03 |
97,66 99 |
|
|
VII |
|
100 200 |
0,01 0,005 |
99,8 100 |
500 1000 |
0,02 0,003 |
99,33 99,9 |
|
|
VIII |
|
100 200 |
0,5 0,005 |
99 100 |
100 1000 |
0,001 0,0001 |
99,96 100 |
|
Как
видно из табл. 4 при исследовании соединений V – VIII эффект зашиты как при наличии хлор-, так
и ацетат-ионов в присутствии и отсутствии сероводорода составляет более 95%.
Очевидно,
это вызвано большой электронной плотностью кратной связи, ее нуклеофильностью,
с одной стороны и капланарностью с другой.
Что
касается повышенной степени защиты при замене радикала предельного эфира на
радикал непредельного (-![]() , то это, вероятно, вызвано введением в молекулу
дополнительной кратной связи.
, то это, вероятно, вызвано введением в молекулу
дополнительной кратной связи.
Экспериментальная часть
Синтез
1-винил-3,4-(хлор, октоксиметил) циклогексана (соед. I).
На
смесь ![]() , 150 мл серного эфира после охлаждения до 100С и
при постоянном перемешивании по каплям подается
, 150 мл серного эфира после охлаждения до 100С и
при постоянном перемешивании по каплям подается ![]() , отгоняют от растворителя, остаток перегоняют под вакуумом и
выделяют соед.
, отгоняют от растворителя, остаток перегоняют под вакуумом и
выделяют соед.
Синтез
1-винил-3,4-(хлор, 2-хлор-5-оксогексен-2) циклогексана (соед. IV).
В
колбу для синтеза помешают 50 мл серного эфира, ![]() , Смесь нагревают до 250С и при перемешивании по
каплям подают
, Смесь нагревают до 250С и при перемешивании по
каплям подают ![]() , сушки над
, сушки над ![]() , ведется отгонка растворителя под вакуумом водоструйного
насоса. Остаток разгоняют под вакуумом и выделяют соед. IV.
, ведется отгонка растворителя под вакуумом водоструйного
насоса. Остаток разгоняют под вакуумом и выделяют соед. IV.
Синтез
1-винил-3,4-(диэтиламинодитиокарбомат, октоксиметил) цикло -гексана (соед. V).
В
колбе перемешивают 59,85г (0,35гм) натриевой соли N,N-диэтиламинодитиокарбомата с 150 мл
этилового спирта до полного растворения соли. Затем постепенно добавляют
1-винил-3,4-(хлор, октоксиметил) циклогексан в количестве 100,28 г (0,35гм).
Смесь перемешивают 2 ч. при температуре конденсации спирта. Затем добавляют 200
мл воды, органический слой извлекают эфиром, сушат ![]() , после отгонки эфира остаток перегоняют под вакуумом и
выделяют соед. V.
, после отгонки эфира остаток перегоняют под вакуумом и
выделяют соед. V.
Аналогично
были синтезированы соед. VI-VII.
Синтез
1-винил-3,4-(диэтиламинодитиокарбомат, 2-хлор-5-оксогексен-2) циклогексана
(соед. VIII).
В
колбу для синтеза помещают ![]() . Разгонкой под вакуумом выделяют
1-винил-3,4-(диэтиламинодитио-карбомат, 2-хлор-5-оксогексен-2) циклогексан
(соед. VIII).
. Разгонкой под вакуумом выделяют
1-винил-3,4-(диэтиламинодитио-карбомат, 2-хлор-5-оксогексен-2) циклогексан
(соед. VIII).
Литература
1.
Поконова Ю.В. Химия и технология галоген
эфиров. Л.: ЛГУ, 1982, 249 с.
2.
Исагулиянц В.И и др. 1,3-дихлорбутен-2 и
новые препараты на его основе. //Ж. Успехи химии, 1964, т.XXXIII, вып.1, с.55.
3.
Байрамов Г.И. Алкоксиметилгалогенирование
замещенных циклогексенов, синтез и применение производных продуктов. Канд.
диссертация. Канд. хим. наук . Баку, 1988, 89-20 с.
4.
Шыхмамедбекова А.З., Мамедярова И.Ф., Байрамов
Г.И., Бахшиева Д.А., Селимханова Д.Г. //Авторское свидетельство СССР №1540230,
С07, С32900, А01 №47/00, 1989,
5.
Жук Н.П. Курс коррозии и зашита металлов
М.: Металлургия, 1968, 316 с.
Поступила в редакцию 11.01.2009 г.