Клинико-иммунологическая эффективность
небулайзерной терапии ронколейкином при атопической бронхиальной астме у детей
Эюбова
Амаля Абдулла гызы,
профессор, зав. кафедрой детских
болезней ІІ, заслуженный деятель наук,
Султанова
Наиля Гасан гызы,
кандидат медицинских наук, доцент.
Азербайджанский медицинский университет,
г. Баку.
Kliniko-immuno efficiency aerosol
therapy of ronkoleykin at the atopic bronchial asthma at children
A.
A. Eyyubova, N. Q. Sultanova,
The Azerbaijan Medical University, Baku.
В
статье приведены результаты клинико-иммунологического обследования 52 больных
атопической бронхиальной астмой, получавших как традиционное лечение (первая
группа), так и небулайзерную терапию Ронколейкином на его фоне (вторая группа).
Использование
сочетанного применения Ронколейкина в комплексном лечении атопической бронхиальной
астмы привело, в сравнении с базисной терапией, к нормализации основных
параметров иммунной и цитокиновой систем организма и к более быстрой положительной
динамике клинических проявлений заболевания, по сравнению с первой группой
больных. В первой группе детей, находившихся на современном базисном лечении,
напротив, сохранялись изменения в иммунном и цитокиновом статусе, а также наблюдалось
меньшее по количеству снижение дневных и ночных приступов удушья.
Ключевые слова: бронхиальная астма, дети, цитокины
In article results kliniko-immuno inspections
by 52 sick atopic bronchial asthma, receiving as traditional treatment (the
first group), and aerosol therapy by Ronkoleykin on its background (the second
group) are resulted.
Use both in complex treatment of an atopic
bronchial asthma has resulted applications of Ronkoleykin, in comparison with
basic therapy, to normalisation of key parametres immune and cytokin systems of
an organism and to faster positive dynamics of clinical displays of disease, in
comparison with the first group of patients. In the first group of children who
were on modern basic treatment, on the contrary, changes in immune and cytokine
the status remained, and also smaller decrease by quantity of day and night
attacks of an asthma was observed.
Keywords:
bronchial asthma, children, cytokine.
Бронхиальная астма – одно из наиболее распространённых хронических
заболеваний у детей, имеющих высокую социальную значимость. Распространенность
бронхиальной астмы у детей достигает 30% в различных популяциях [1, 3, 8]. В
большинстве случаев у детей развитие бронхиальной астмы связано с
иммуноглобулин Е - опосредованными механизмами, ответственными за развитие
аллергических реакций. Ведущая роль в формировании аллергического воспаления
принадлежит CD4+ лимфоцитам, которые подразделяются на Т-хелперы 1 и
2 типов (Thl и Тh2).
Каждому из них соответствует определенный «профиль» секретируемых ими цитокинов
[4, 7].
Наряду с ростом числа больных, страдающих астмой, отмечается устойчивая
тенденция к увеличению количества больных, резистентных к традиционной терапии,
регламентируемой отечественными и международными программами [3]. Основные
этапы лечения бронхиальной астмы основываются на применении так называемой
«базисной» терапии, соответствующей степени тяжести заболевания (кромоны,
ингаляционные или системные глюкокортикостероиды) и «симптоматической» терапии,
направленной на снятие бронхообструктивного синдрома. Учитывая, что для
бронхиальной астмы характерно изменение функционального состояния иммунной и
цитокиновой системы, чрезвычайно важное значение имеет введение в комплекс
терапевтической программы цитокиновых препаратов. С этой целью нами был исследован
препарат Ронколейкин, при лечении атопической бронхиальной астмы у детей.
Имеющиеся работы демонстрируют его ярко выраженную иммунотропную активность [5,
6]. Например он:
- восстанавливает
синтез эндогенного IL-2 активированными CD4+ и CD8+
клетками, компенсируя дефицит эндогенного IL-2;
- воздействует на
клетки-мишени: NK-клетки, Т-хелперы, цитотоксические Т-лимфоциты, B-лимфоциты,
моноциты, являясь для них фактором активации, пролиферации и дифференцировки;
- регулирует
Th1/Th2 баланс;
- отменяет
иммунологическую толерантность, предохраняет активированные Т-клетки от преждевременной
гибели (апоптоза);
- осуществляет
регуляцию и взаимодействие механизмов врожденного и приобретенного иммунитета;
- стимулирует
реализацию зависимого и независимого от антигена иммунного ответа, влияет как
на клеточное, так и на гуморальное звено иммунитета.
Целью проведения настоящего исследования явилось изучение клинико-иммунологической
эффективности небулайзерной терапии препаратом Ронколейкин у детей, больных
атопической бронхиальной астмой.
Материал и методы
исследования
Для реализации поставленной цели
нами были обследованы 52 ребенка, больных средне-тяжелой и тяжелой персистирующей
бронхиальной астмой в возрасте от 3-х до 17 лет. Обследование пациентов и
клинико-лабораторное исследование проводились на базе аллергологического
отделения детской клинической больницы №6 г. Баку и кафедры детских болезней II Азербайджанского медицинского университета. Диагноз
бронхиальной астмы ставили в соответствии с критериями GINA(2006).
Обследованные больные были
разделены на две группы. Больные первой группы (30 человек) получали базисное
противовоспалительное лечение. Больные второй группы (22 человека) на фоне
базисной терапии дополнительно получали Ронколейкин ингаляционно через
небулайзер: дети до 5 лет - по 250 000 ед. с интервалом 48 часов
четырехкратно; старше 5 лет – по 500 000 ед. по той же схеме. Контрольную группу составили 15 практически здоровых
детей того же возраста.
Эффективность лечения оценивали
по динамике клинических симптомов и иммунологических показателей. Клиническими
критериями эффективности проводимого лечения являлись длительность ремиссии, уменьшение
частоты дневных и ночных приступов бронхиальной астмы, а также потребности в
β2-агонистах короткого действия.
Параметры иммунного статуса
включали определение показателей клеточного звена иммунитета (CD3+,
CD4+, СD8+, СD16+/ СD56+ , СD19+
-лимфоциты) с использованием моноклональных антител («Becton Dickinson», США). Идентификацию мембранных маркеров
иммунокомпетентных клеток периферической крови проводили методом проточной цитометрии
на проточном цитометре «Epics XL» («Beckman Coulter», Франция) с применением
автоматического программного обеспечения. Для обработки результатов
использовали программу СellQuest («Becton Dickinson», США),
используя параметры прямого (FSC), бокового (SSC) светорассеяния.
Методом твердофазного
иммуноферментного анализа определяли содержание ИЛ-2, ИЛ-6, ИЛ-10, ИЛ-12, TNFa, IgE в сыворотке крови
наблюдаемых больных с использованием коммерческих тест-систем, согласно
прилагаемой к ним инструкции («Biosourse», США). Учет результатов ИФА проводили на планшетном фотометре
«Multiscan plus» (Labsystems, Финляндия).
Результаты, полученные в процессе
исследования, обрабатывались методом математической статистики при помощи
компьютерного пакета обработки данных «STATISTICA 6,0» для работы в среде
Windows [2]. Результаты исследования представлены в виде средней
арифметической, средней ошибки средней арифметической и пределов колебаний
(максимальное и минимальное значение). Достоверность изменений показателей по
сравнению с нормой определяли при помощи парного критерия Вилкоксона. Различия
считались достоверными при p < 0,05.
Результаты
и обсуждение
Анализ полученных результатов
показал, что под влиянием проводимой терапии у больных второй группы,
получавших аэрозольтерапию Ронколейкином, происходила более быстрая
положительная динамика клинических проявлений бронхиальной астмы, по сравнению
с первой группой больных, находящихся на базисном лечении. При этом у больных
второй группы отмечалось более выраженное уменьшение частоты как дневных, так и
ночных приступов бронхиальной астмы к концу курса лечения (рисунок 1).
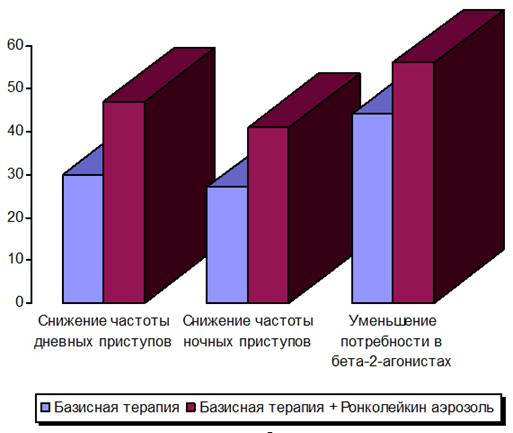
Рис. 1. Сравнительная клиническая эффективность
проводимого лечения.
Так, у обследованных детей второй
группы уменьшилось число дневных приступов удушья – у 47%, ночных приступов – у
41% больных, а у 56% детей снизилась потребность в b2-агонистах короткого действия. Напротив, в группе детей, получавших
только базисное противовоспалительное лечение, количество дневных приступов
удушья снизилось только у 30% детей, количество ночных приступов – у 27% , а потребность
в b2-агонистах короткого действия – в 44%
случаев.
Параллельное изучение иммунного и цитокинового статуса обследованных
больных в динамике лечения дало следующие результаты (таблица 1).
Таблица 1.
Показатели иммунной и цитокиновой системы при различных
схемах лечения больных атопической бронхиальной астмой (М и пределы колебаний).
|
Показатели |
Больные атопической бронхиальной астмой (n=52) |
Базисная терапия + Ронколейкин аэрозоль |
|
|
До лечения |
Базисная терапия |
||
|
Т-лимфоциты, % CD3+ |
42,5 (40,9-44,1) |
48,4 (45,7-51,0) |
54,3 (50,6-58,0) * |
|
Т-хелперы, % CD4+ |
23,8 (21,9-25,7) |
26,9 (25,0-28,8) |
30,1 (28,2-32,0)* |
|
Т-супрессоры, % CD8+ |
18,7 (11,2-26,2) |
21,4 (16,1-26,7) |
24,2 (21,1-27,3)* |
|
ИРИ, ед. CD4+/CD8+ |
1,35 (1,24-1,46) |
1,25 (1,17-1,33)* |
1,37 (1,22-1,52) |
|
Т-лимфоциты/киллеры, % CD16+/56+ |
8,6 (6,2-11,0) |
9,3 (7,6-11,2) |
10,0 (9,1-10,9) |
|
В-лимфоциты,% CD19+ |
21,0 (16,5-25,5) |
18,8 (16,0-21,9) |
16,9 (15,7-18,1)* |
|
IgE, МЕ/л |
343,5 (333,5-359,7) |
310,3 (297,1-317,2)* |
283,6 (262,1-304,8)* |
|
TNFa, pg/ml |
206,3 (34,0-490,0) |
163,4 (30,0-359,5)* |
120,6 (26,0-229,0)* |
|
ИЛ-12, pg/ml |
157,0 (86,6-267,2) |
136,5 (69,3-210,0)* |
116,1 (52,2-160,0)* |
|
ИЛ-10, pg/ml |
7,45 (4,2-12,5) |
6,13 (2,8-9,7) |
4,61 (1,5-7,1)* |
|
ИЛ-6, pg/ml |
17,1 (6,9-29,2) |
16,5 (5,1-25,4) |
14,77 (3,2-20,0)* |
|
ИЛ-2, pg/ml |
2,0 (0,3-5,2) |
3,0 (1,0-5,1) |
4,06 (1,8-5,2)* |
Примечание:
* - различия достоверны по сравнению с показателями до лечения (p<0,05).
Как видно из полученных
результатов, после проведения базисного лечения у больных атопической
бронхиальной астмой показатели субпопуляционного состава лимфоцитов практически
не отличались от аналогичных значений до начала лечения. Следовательно, у
больных первой группы базисная терапия не оказала какого-нибудь корригирующего влияния
на клеточное звено иммунитета.
Во второй группе больных,
получавших небулайзерную терапию Ронколейкином на фоне базисного противовоспалительного
лечения, было установлено достоверное повышение параметров клеточного иммунитета.
При этом, у больных второй группы относительное содержание общих Т-лимфоцитов
достоверно возросло с 42,5% до начала лечения и составило 54,3% после лечения
(р<0,05). В этой группе больных на фоне проводимого лечения было отмечено
статистически достоверное повышение показателей Т-лимфоцитов/хелперов (23,8%
против 30,1%, р<0,05), Т-лимфоцитов/супрессоров (18,7% против 24,2%,
р<0,05), а также достоверное снижение содержание уровня В-лимфоцитов в
периферической крови (21,0% против 16,9%, р<0,05). Следовательно, после
проведения комбинированной терапии с включением Ронколейкина в форме аэрозоля,
наблюдалось восстановление показателей клеточного звена иммунной системы.
Повышенный уровень общего IgE, наблюдаемый у детей с атопической
бронхиальной астмой до начала лечения (343,5 МЕ/л), в ходе проведения базисного
лечения у больных первой группы снизился в 1,1 раза и составил 310,3 МЕ/л
(р<0,05), а при проведении комбинированной терапии у больных второй группы –
в 1,2 раза и составил 283,6 МЕ/л (р<0,05).
Изучение показателей цитокинового
статуса больных атопической бронхиальной астмой в динамике проведенного лечения
по разным схемам терапии дало следующие результаты. Так, применение только базисной
терапии в лечении больных первой группы привело к достоверному снижению
содержания TNFa (206,3 pg/ml
до лечения против 163,4 pg/ml после лечения, p<0,05)
и ИЛ-12 (157,0 pg/ml до лечения против 136,5 pg/ml после лечения, p<0,05) в сыворотке крови. Изменение уровней
остальных цитокинов в сыворотке крови в первой группе больных было не
достоверно (р>0,05).
Во второй группе больных после
проведения лечения (базисная терапия+Ронколейкин аэрозоль) отмечалось
достоверное изменение значений всех изученных цитокинов (р<0,05). Так,
содержание в сыворотке крови TNFa было снижено в 1,7 раза и составило 120,6 pg/ml,
ИЛ-12 – в 1,3 раза (116,1 pg/ml), ИЛ-10 – в 1,6 раза (4,61 pg/ml),
ИЛ-6 – в 1,1 раза (14,77 pg/ml). Уровень ИЛ-2 на фоне проводимого лечения,
напротив, был повышен в 2,0 раза и составил 4,06 pg/ml
(р<0,05).
Таким образом, использование
сочетанного применения небулайзерной терапии Ронколейкином на фоне базисного
противовоспалительного лечения атопической бронхиальной астмы у детей приводит
к нормализации основных параметров иммунной и цитокиновой систем организма. В
условиях дальнейшего трехмесячного мониторинга отмечалась полная нормализация
иммунологических и цитокиновых параметров во второй группе больных, у которых в
комплексном лечении заболевания использовали базисную терапию и местное введение
Ронколейкина, в то время как в первой группе детей, находившихся на современном
базисном лечении, по-прежнему сохранялись изменения в иммунном и цитокиновом
статусе, что свидетельствовало о формировании вторичных дисфункциональных
нарушений иммунной системы.
Литература
1. Баранов А.А., Балаболкин И.И. Детская аллергология. М., 2006.- 687с.
2. Боровиков В.П. Популярное
введение в программу STATISTICA, Компьютер Пресс 1998.
3. Григорьев К.И., Хан М.А., Григорьева О.К.
Бронхиальная астма: Gina, новые инициативы и детская пульмонологическая
практика // Медицинская
помощь: научно-практический журнал. - 2007. - N 3 . - С.
3-8.
4.
Клиническая аллергология: Рук-во для практических врачей / Под. ред. акад. Р.М.
Хаитова. М.: МЕДпресс-информ, 2002. 624 с.
5. Курманова Г.М., Рамазанова
Ш.Х., Мажитова З.Х. Опыт применения Ронколейкина у детей, больных бронхиальной
астмой в приступный период. // Медицинская иммунология, 2003: том 5, № 3-4, с.
233.
6. Николаева З.К., Егорова В.Н.,
Козлов В.К. Ронколейкин – рекомбинантный интерлейкин-2 человека: фармакология и
биологическая активность: Пособие для врачей // СПб.: Изд. СПб ун-та, 2002. 40
с.
7. Просекова Е.В., Деркач В.В.,
Сабыныч В.А. и др. Состояние иммунных и цитокиновых механизмов при
аллергических забролеваниях у детей // Pacific Medical Journal. – 2007. - № 2.
- с.57–60.
8. Цибулькина В.Н. Бронхиальная
астма: распространенность, механизмы развития, факторы, определяющие тяжесть
заболевания, общие принципы специфической и неспецифической терапии// Казанский
медицинский журнал. – 2005. – т.86. - № 5. – с. 353 – 360
Поступила в
редакцию 09.06.2010 г.