Синтез сложных эфиров 3α, 12α-дигидроксихолановой кислоты и их продуктов ацилирования
Кадыров Абдурахмон Хафизович,
доктор химических наук, профессор,
Назарова Зульфия Джалиловна,
кандидат химических наук,
Султонмамадова Маина Парвонаевна,
аспирантка.
Институт химии им. В.И.Никитина АН Республики Таджикистан.
| Описание ГДЗ по русскому языку 4 класс Канакина описание www.euroki.org |
Synthesis of esters 3α, 12α-digidroksiholanovoy acid their products acylation
A.H.Kadirov, Z.D. Nazarova, M.P. Sultonmamadova,
V. I. Nikitin Institute of chemistry, Academy of Sciences of the Republic of Tajikistan.
Синтезированы различные эфиры 3α,12α-дигидроксихолановой кислоты, а также продукты их ацилирования.
Ключевые слова: 3α,12α-дигидроксихолановая кислота, сложные эфиры ацилирование.
Synthesize various esters of 3α, 12α-digidroksiholanovoy acid and the products of acylation.
Keywords: 3α, 12α-digidroksiholanovoy acid, esters of acylation.
В последнее десятилетие проводится интенсивное изучение новых представителей класса стероидных соединений с целью выявления взаимосвязи структуры биологической активности [1].
Недавно на основе 3α,7α,12α-тригидроксихолановой кислоты были получены катионные стероидные антибиотики, которые взаимодействуют с липидами и обладают как бактериостатической, так и бактерицидной активностями [2].
Известно, что во многих случаях холановые кислоты и их ряд производных служат эффективным средством для лечения желчнокаменной болезни, а также для лечения других заболеваний печени.
В этом плане следует отметить, что задачей проводимых исследований является нахождение путей использования природных желчных кислот с целью синтеза биологически активных соединений.
Результаты и их обсуждение
Особый интерес здесь представляет структура 3α,12α-дигидроксихолановой кислоты, которая содержит гидроксильные группы в экваториальном и аксиальном положении легко окисляемых, ацилируемых, что представляет возможность синтезировать ряд других производных холановых кислот, которые в последующем могут явиться исходным сырьём для получения литолитических препаратов.
Исходя из этого, нами в первую очередь был осуществлен синтез сложных эфиров 3α,12α-дигидроксихолановой кислоты:
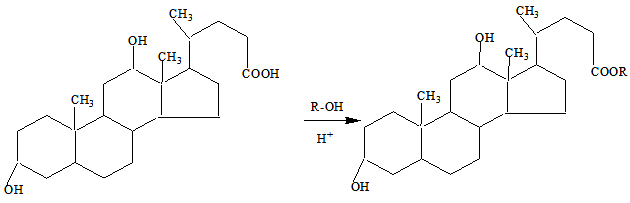
где R=CH3, C2H5,C3H7,изо- C3H7.C4H9.
В результате проведения реакции этерификации, исходя из метилового, этилового, пропилового, изопропилового и бутилового спирта, нами был синтезирован ряд соответствующих сложных эфиров 3α,12α-дигидроксихолановой кислоты (I-V). Реакции проводили при кипячении спиртов с 3α,12α-дигидроксихолановой кислоты в присутствии следов минеральных кислот.
Выход и данные элементного анализа, а также температуры плавления синтезированных нами сложных эфиров 3α,12α-дигидроксихолановой кислоты приведены в таблице 1.
Таблица 1.
Характеристика сложных эфиров 3α,12α-дигидроксихолановой кислоты.
|
№ п/п |
сложных эфиров 3α,12α-дигидрокси- холановых кислоты |
Вы-ход,% |
Т.пл.°С |
С,% Найдено Вычислено |
Н,% Найдено Вычислено |
Брутто- формула |
|
I |
Метиловый |
87 |
75-76 |
73.76 73.84 |
10.33 10.41 |
С25Н42О4 |
|
II |
Этиловый |
85 |
79-80 |
74.11 74.24 |
10,44 10.54 |
С26Н44О4 |
|
III |
Прпиловый |
84 |
42-43 |
74.51 74.60 |
10.59 10.66 |
С27Н46О4 |
|
IV |
Изопропиловый |
86 |
69-70 |
74.64 74.60 |
10.71 10.66 |
С27Н46О4 |
|
V |
Бутиловый |
87 |
39-40 |
74.88 74.95 |
10.68 10.78 |
С28Н48О4 |
Как видно из данных таблицы 1, выходы сложных эфиров 3α,12α-дигидроксихолановой кислоты колеблются в пределах 84-87%.
ИК-спектральное их исследование подтверждает факт протекания реакции, что объясняется появлением в спектрах всех соединений интенсивных полос поглощения в области 1280-1150 см-1, характеризующих наличие эфирных групп в исследуемых молекулах.
Синтезированные сложные эфиры 3α,12α-дигидроксихолановой кислоты хроматографировали при следующих условиях: температура колонки-2500С, испарителя 2900С, детектора 2700С, скорость газа-носителя 40мл/мин, водорода 30мл/мин, на хроматоне- AW с диаметром зернения 0,160-0,200мм, содержащем SE-30.
Полученные данные – спектров и газожидкостной хроматографии позволяют сделать выводы, подтверждающие строение полученных нами сложных эфиров 3α,12α-дигидроксихолановой кислоты.
Продолжая синтезы с целью получения препаратов, растворяющих холестериновые желчные камни и камни желчных протоков, нами были осуществлены некоторые реакции на основе сложных эфиров 3α,12α-дигидроксихолановой кислоты-(I-V), с использованием гидроксильной группы в положение у С-3.
Однако, на наш взгляд самостоятельный теоретической препаративно интерес представляет исследование возможности химических свойств сложных эфиров 3α,12α-дигидроксихолановой кислоты, так как это позволяет расширить информацию о реакционной способности вышеназванных сложных эфиров и их поведении в реакции ацилирования [3]. Ацилирование метилового эфира 3α,7α,12α-тригидроксихолановой кислоты и его некоторых производных уксусным ангидридом изучено достаточно подробно, но сведения об их других сложных эфирах дезоксихолевой кислоты с уксусным ангидридом практически отсутствуют [4]. С целью поиска оптимальных условий ацилирования сложных эфиров 3α,12α-дигидроксихолановой кислоты было изучено их взаимодействие в эквимолекулярном соотношении с уксусным ангидридом, а также при комнатной температуре в интервале от 23-250С:
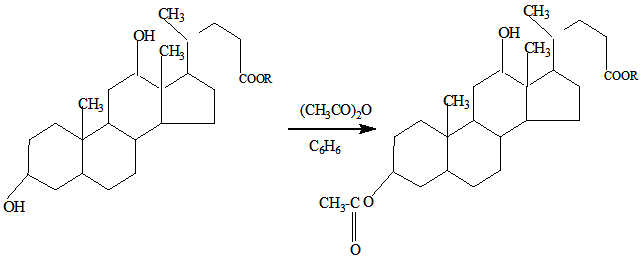
где R=CH3, C2H5, C3H7, изо- C3H7,C4H9.
В найденных условиях было осуществлено ацилирование метилового(I), этилового-(II), пропилового-(III), изопропилового-(IV) и бутилового-(V) сложных эфиров 3α,12α-дигидроксихолановой кислоты, их свойства, данные элементного анализа приведены в таблице 2. Идентификация полученных сложных эфиров 3α-ацил-12α-гидроксихолановой кислоты проводилась сравнением с их свойствами.
Ацилирование в разработанных для сложных эфиров 3α,12α-дигидроксихолановой кислоты, условиях показало, что выход продуктов ацилирования повышается при использование изопропилового и бутилового эфиров 3α,12α-дигидроксихолановой кислоты.
В таблице 2 приведена физико-химическая характеристика, выходы и данные элементного анализа 3α-ацето-12-гидрокси эфиров холановой кислоты (I-V), свидетельствующие о том, что во всех случаях мы имеем дело со вступлением одной ацильной группы в молекуле стероида.
В ходе исследований нами было экспериментально установлено, что найденные условия ацилирования являются наиболее оптимальными.
Как видно из данных таблицы 2 выходы ацилпроизводных колеблются в пределах 80-95%. ИК - спектральное их исследование подтверждает факт о протекании реакции, что объясняется появлением в спектрах всех соединений-(I-V) полос поглощения в области
1280-1150 см-1, характеризующих наличие эфирных групп, а также в области 1340-1350 см-1 присутствует характерная полоса поглощения валентного колебания ацетильной групп.
Таблица 2.
Характеристика ацилпроизводных сложных эфиров 3α,12α-дигидрокси-холановой кислот.
|
№ п/п |
Ацилпроизводные сложных эфиров 3α,12α-дигидрокси- холановых кислоты |
Вы-ход,% |
Т.пл.°С |
С,% Найдено Вычислено |
Н,% Найдено Вычислено |
Брутто формула |
|
I |
Метиловый |
80 |
62-63 |
72.20 72.28 |
9.80 9.88 |
С27Н44О5 |
|
II |
Этиловый |
85 |
65-66 |
72.59 72.68 |
9,22 10.02 |
С28Н46О5 |
|
III |
Пропиловый |
82 |
52-53 |
73.10 73.06 |
10.04 10.14 |
С29Н48О5 |
|
IV |
Изопропиловый |
87 |
58-59 |
73.10 73.06 |
10.04 10.14 |
С29Н48О5 |
|
V |
Бутиловый |
95 |
38-39 |
73.32 73.42 |
10.17 10.27 |
С30Н50О5 |
В дальнейшем нами была предпринята попытка провести встречный синтез с целью установления строения исходной 3α,12α-дигидроксихолановой кислоты (I). Для решения этой задачи нами была изучена реакции гидролиза полученной 3α-ацето, 12α-гидроксихолановой кислоты.
Полученные различными путями производные 3α,12α-дигидроксихолановой кислоты оказались совершенно идентичным по свойствам, ИК-спектральным характеристикам, а также по отсутствии депрессии смещенной пробы плавления.
Таким образом, нами было исследовано поведение различных эфиров 3α,12α-дигидроксихолановой кислоты в реакции ацилирования и показано, что проведение таких реакций вполне осуществимо, а также посредством их можно получать многочисленные производные холановых кислот, проявляющие себя как потенциальные биологические активные соединения.
Экспериментальная часть
Синтез метилового эфира 3α,12α-дигидроксихолановой кислоты.
В круглодонную колбу емкостью 50 мл, добавляют 0,5 грамм (0,00127моль) дезоксихолевой кислоты и 35 мл абсолютного метанола и 1 каплю концентрированной серной кислоты. Смесь кипятят в течение 2,5-3 часов. После охлаждения трижды экстрагируют по 50 мл эфиром. Эфирные экстракты объединяют, промывают водой до рН=7 и сушат над Na2SO4. После фильтрования упаривают растворитель.
Выход продукта 0,45 грамм (87%), т.пл.75-760С. Для С25Н47О4 (411,62): Найдено в %: С-73,76. Н-10,33. Вычислено в %: С-73,84, Н-10,41.
ИК спектры, ν, см-1: 1275-1280 (COOR); 3180-3440(ОН);
Аналогичным образом были получены другие сложные эфиры 3α,12α-дигидроксихолановой кислоты (II, III, IV, V), представленные в таблице 1.
Синтез 3-ацето 12-гидрокси метилового эфира холановой кислоты.
В круглодонную колбу емкостью 50 мл, добавляют 0,2 грамм (0,00049моль) метилового эфира 3α,12α-дигидроксихолановой кислоты, 0,53 мл бензола, 0,22 мл пиридина, 0,22 мл (0,0021моль) уксусного ангидрида. Реакционную смесь оставляют при температуре 250С в течение 12-14 часов.
После чего смесь разбавляет водой, и отделяют бензольный слой, промывают водой и сушат над Na2SO4.
Выход продукта 0,11 грамм (80%), т.пл.62-630С. Для С27Н44О5 (448,61): Найдено в %: С-72,20, Н-9,80. Вычислено в %: С-72,28, Н-9,88.
ИК спектры,ν, см-1: 1275-1280 (COOR); 3180-3440 (ОН);1340-1350 (CH3CO-)
Аналогичным образом были получены другие ацилпроизводные 3α,12α-дигидроксихолановой кислоты (II, III, IV, V) в таблице 2.
Литература
1. Miller A. D. \\ Angew. Chem. Int. Ed. 1998. V. 37. P. 1768-1785.
2. Tu N. et al Bile acid conjugates of a no steroidal glucocorticoid receptor modulator \\ Bioorg. Med. Chem. Litt. -2004. –V. 14.-p. 4179-41-83.
3. М.М. Муродова, А. Х. Кадыров, З. Д. Назарова, Хайдаров К.Х. Модификационный синтез некоторых производных холановых кислот. \\Докл АН РТ, 2006, т 49, №10-12. –с. 933-938.
4. A. Kannon, E.De clercg, C. Pannecougue, M. Witvrouw, T. L. Hartman, J.A. Turpin. R. W. Buckheit, Jr. and M. Cushman Synthesis and anti-HIV activity of a bile acid analog of catalane. Tetrahedron 57 (2001) p. 9385-9391.
Поступила в редакцию 24.07.2012 г.