Синтез на основе 3α,7α-дигидрокси -12-кетохолановой кислоты
Кадыров Абдурахмон Хафизович,
доктор химических наук, профессор,
Саидов Самир Сангинович,
кандидат химических наук, доцент,
Абдурахимова Мохруби Кодыровна,
соискатель.
Таджикский национальный университет.
Институт химии им. В.И.Никитина АН Республики Таджикистан.
Sintesis of the basis 3α,7α-dyhidroxy-12-ketochic acid
Кadirov A.Н., Saidov S.S., Abdyrachimova M.K.
TaJik National University.
V.I.Nikitin Institut of Chemistry, Academy of Sciences of the Republic of Tajikistan.
Рассмотрено поведение 3α,7α-дигидрокси-12-кетохолановой кислоты в реакциях ацилирование и другие реакции различного характера.
Ключевые слова: синтез, сложные эфиры, 3α,7α-дигидрокси-12-кетохолановой кислоты, гидролиз, ацилирование, восстановление.
The behavior of the 3α, 7α-dyhidroxy-12-ketoholanovoy acid acylation and other reactions of various kinds.
Keywords: synthesis, esters, 3α, 7α-dyhidroxy-12-ketoholanovoy acid acylation.
Среди многих физиологически активных стероидов важное место занимают холановые кислоты. Особый интерес представляют производные 3α,7α, 12α-тригидрокси-, 3α,7α-дигидрокси-, 3α,7α, 12α-трикето и 3α,7α- дигидрокси-12-кетохолановых кислот, которые содержат различные функциональных группы, что даёт возможность синтезировать ряд производных холановых кислот, которые могут быть исходным сырьём для получения литолитических препаратов, а также поликатионных амфифилов[1-3].
Синтез некоторых производных холановых кислот на основе использования их гидроксильных, кетонных и карбоксильных и эфирных групп открывают широкий диапазон в органической химии, который позволяет вести направленный синтез новых препаратов, растворяющих холестериновые желчные камни при желчнокаменной болезни.
В связи с этим нахождение удобных методов синтеза различных эфиров, ацетатпроизводных и кетопроизводных, а также модификация их структуры с целью получения новых биологически активных соединений, представляет собой актуальную задачу, как в плане развития органического синтеза, так и для практической медицины.
Результаты и их обсуждения
Развивая исследования по синтезу различных производных холановых кислот [4], мы описываем в этой работе полученные новые ацилпроизводные различных сложных эфиров 3α,7α-дигидрокси-12-кетохолановой кислоты, а так же поведение других превращений.
Поскольку природные холановые кислоты сами могут являться эффективными средствами для лечения при желчнокаменной болезни, часть представленного исследования была направлена на поиск путей использования природных холановых кислот, а также выявление взаимосвязи методом строениям соединений и их биологической активности.
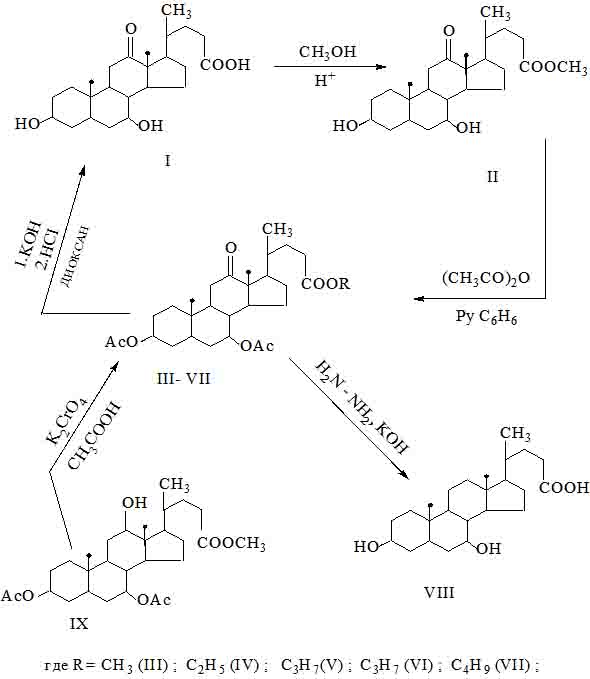
В связи с этим, нами на первой плане был осуществлен синтез метилового эфира 3α,7α-дигидрокси-12-кетохолановой кислоты (II). Реакцию проводили при кипичении метанола с продукта (I) в присутствии следов концентрированной серной кислоты.
Далее было изучено поведение гидроксильных групп у углерода С-3 и С-7 в молекуле метилового-, пропилового-, изопропилового и изобутилового эфиров 3α,7α-дигидрокси-12-кетохолановой кислоты в реакциях ацилирования. Реакция последнего с уксусным ангидридом показала, что при комнатной температуре, за 13-15 часов в среде пиридина наблюдается образование соответствующих ацилпроизводных-(III- VII), с почты количественным выходом.
В дальнейшем нами было предпринято попытка провести встречный синтез с целью установления строения метилового эфира 3α,7α-диацетокси-12-кетохолановой кислоты- (III). Для решения этой задачи проведено окисление известного метилового эфира 3α,7α-диацетокси-12-кетохолановой кислоты – (IХ), до продукта (III).
Окисление 3α,7α-диацетокси-12-гидроксиметилхолата направленные по гидроксильной группе у атома углерода С-12. Это нами удалось осуществить путём растворения исходного соединения в растворе уксусной кислоты и обработке раствором хромата калия.
Полученные различными путями метилового эфира 3α,7α-диацетокси-12-кетохолановой кислоты -(III) оказался совершенно идентичным по свойствам, ИК спектральным характеристикам, а так же смещенная проба плавления депрессии не даёт.
Целью установления строения исходного соединения 3α,7α-дигидрокси-12-кетохолановой кислоты - (1). Продукт (III) был подвергнут щелочному гидролизу 30%-ным раствором едкого калия в растворе диоксана в течение 1,5-2 часов. В результате этого нами было выделена калиевая соль 3α,7α-дигидрокси-12-кетохолановой кислоты. Полученную соль без выделения из реакционной смеси подвергали кислотному гидролизу, и был выделен подходящим методом 3α,7α-дигидрокси-12-кетохолановой кислоты - (I), с выходом 86%.
В заключение приводятся результаты ещё одной реакции, в которой было предпринята попытка восстановить кетогруппа в положение у С-12 в молекуле этилового эфира 3α,7α-диацетокси-12-кетохолановой кислоты-(IV) по Кижнеру-Вольфу.
Реакцию проводят в среде этиленгликоля в присутствии гидразингидрата с применением раствора едкого калия, выделенного из реакционной смеси с выходом 68%, 3α,7α-дигидроксихолановой кислоты - (VIII). Важнейшие характеристики, выходы и данные элементного анализа синтезированных соединений приведены в таблице 1.
В ИК-спектрах соединений-(I-IХ) обнаружены основные полосы поглощения характерных групп. Так в области 1060 и 1260 см-1 наблюдается полоса поглощения средней интенсивности, соответствующая эфирному фрагменту, который присутствует в полученных соединениях- (II,III,IV,V,VI,VII и IХ). В ИК-спектрах соединений (I,II,VIII и IХ) обнаружены интенсивные полосы поглощения в области 3155-3450 см-1 которые отнесены к валентным и деформационным колебаниям ОН-группы.
В спектрах соединений (I-VII) вместо них
обнаружены интенсивные полосы поглощения в области 1700-1710см-1,
свидетельствующие о наличии >С=О группы, а так же в области 1340-1350см-1
присутствует характерная полоса поглощения валентного колебания ацетильных
групп .
.
Чистота и индивидуальность некоторых продуктов синтеза (II-VII) определялась методом тонкослойной и газовой хроматографии. В качестве растворителя использовали систему хлороформ: метанол в соотношении (7:3) проявителем служила пары йода.
Таким образом, нами сделано попытка всестороннего получения поведения ряда производных холановых кислот в реакциях различного характера и показано, что проведение подобных превращение вполне возможно, и с помощи их можно синтезировать ряд новых производных холановых кислот которые могут быть исходным продуктом для получение биологически активных соединений.
Экспериментальная часть
Синтез на основе 3α,7α-дигидрокси-12-кетохолановой кислоты (I).
В колбу емкостью на 150 мл добавляли 10г (0,019моля) 3α,7α-диацетокси-12-кетометилхолата, 40 мл диоксана и 6,5г (0,11моля) КОН в 12 мл дистиллированной водой. Смесь кипятили в течение 3,5 часов, а затем после охлаждения нейтрализовали разбавленной соляной кислотой до рН=7 и экстрагировали эфиром. Эфирные вытяжки промывали водой сушили над Na2SO4. После отгонки растворителя продукт перекристализовали из этилового спирта.
Выход продукта 94%,Т.пл.221-222оС.
Для С24Н48О5 (416,07): найдено в %: С-70,79 Н-9,39.
Вычислено в % С-70,93 Н-9,3.
Таблица 1.
Характеристика синтезированных соединений.
|
№ п/п |
Холановых кислот |
Выход % |
Т.пл. 0С |
С, % найдено/ вычислено |
Н, % найдено/ вычислено |
Брутто- формула |
|
I |
3α,7α-дигирокси-12-кето- |
86 |
221-222 |
70,79/70,93 |
9,39/9,30 |
С24Н48О5 |
|
II |
метиловый эфир3α,7α-дигидрокси-12-кето- |
96 |
178-179 |
71,28/71,39 |
9,48/9,59 |
С25Н42О5 |
|
III |
метиловый 3α,7α-диацето-12-кетоэфир3α,7α-диацето-12-кето- |
97 |
177-178 |
64,56/64,66 |
8,62/8,56 |
С29Н44О7 |
|
IV |
этиловый эфир3α,7α-диацето-12-кето- |
89 |
104-105 |
69,41/69,36 |
8,80/8,86 |
С30Н46О7 |
|
V |
пропиловый эфир 3α,7α-диацето-12-кето- |
93 |
179-180 |
69,66/69,76 |
9,17/9,25 |
С31Н49О7 |
|
VI |
изопропиловый эфир3α,7α-диацето-12-кето- |
91 |
92-93 |
69,88/69,92 |
8,77/8,83 |
С31Н47О7 |
|
VII |
изобутиловый эфир 3α,7α-диацето-12-кето- |
88 |
60-61 |
70,23/70,32 |
9,08/9,15 |
С32Н50О7 |
|
VIII |
3α,7α-дигидрокси- |
68 |
140-141 |
73,50/73,36 |
10,11/10,18 |
С24Н40О4 |
|
IХ |
метиловый эфир-3α,7α-диацето-12-гидрокси- |
71 |
186-187 |
67,14/67,21 |
9,47/9,54 |
С27Н46О7 |
Синтез 3α,7α—диацето-12-кетопропилхолат- (V).
В колбу помещают 5г (0,011моля) пропилового эфира 3α,7α-дигидрокси-12-кетохолановой кислоты и растворяют, в 24 мл сухой бензол добавляют, 6 мл пиридина и 6 мл уксусного ангидрида. После чего реакционную смесь оставляют при 250С на 20 часов. Смесь разбавляют водой, бензолный слой отделяют, промывают и сушат над сульфатом натрия. После фильтруют, отгоняют растворитель, и остаток перекристаллизовывают из смеси метанол воды в соотношение 2:1.
Выход продукта 5,5г , 93%, Т.пл.179-180 0С.
Для С31Н48О7 (532,6): найдено в % С-99.66, Н-9,17.
Вычисленно в % С-69,76; Н-9,25Аналогичным образом были получены другие ацетилпроизводные сложных эфиров 3α,7α- дигидрокси -12-кетохолановой кислоты (III,IV,VI,VII), представленные в таблице 1.
Литература
1. Султонмамадова М.П., Кадыров А.Х., Хайдаров К.Х. Синтез сложных эфиров 3α,7α,12α-трикетохолановой кислоты // Докл.АН РТ, 2011, том. 54., №8. –с 649-652.
2. Соколик В.Н., Маслов М.А., Морозова Н.Г., Серебреникова Г.А. Синтез поликатионных амфифилов на основе холевой кислоты // Вестник МИТХТ, 2010, т.5, №6. -с.58-62.
3. Соколова Т.В., Маслов М.А., Серебреникова Г.А. Получение катионных амфифилов на основе дезоксихолевой кислоты. Биоорганическая химия.2004. т.30 .№5 .-с.531-536.
4. Муродова М.М., Кадыров А.Х., Назарова З.Д., Хайдаров К.Х. Модификационный синтез некоторых производных холановых кислот // Докл. АН РТ. 2006. т.49. -№10 -12. -с.933-938.
Поступила в редакцию 12.10.2012 г.