Морфологическая оценка эмбрионов, полученных от овцематок – доноров
Алибаев Нурадин,
доктор сельскохозяйственных наук, профессор,
Адилбеков Нургали,
кандидат сельскохозяйственных наук,
Юго-Западный научно-исследовательский институт растениеводства и животноводства.
Абай Гаухар,
PhD докторант,
Южно-Казахстанский государственный университет им. М.Ауезова.
Одним из наиболее важных этапов в технологии трансплантации эмбрионов является получение достаточного количества зародышей путем вызывания суперовуляции.
В ходе изучения были оценены стадии развития 356 эмбрионов, полученных от овцематок-доноров, обработанных ГСЖК, полученным от кобыл разного возраста и сроков жеребости.
Выход эмбрионов отличного качества об общего числа вымытых эмбрионов при традиционном способе составил 21,3±3,4%, хорошего качества – 55,3±4,2%, удовлетворенные качества – 17,7±3,2% и дегенерированные качества – 5,7±1,9%. При новом способе получения гонадотропина из сыворотки жеребых кобыл доля эмбрионов отличного качества составила 30,2±3,1%, удовлетворительные качества – 8,8±1,9 и дегенерированных эмбрионов – 2,3±1,0%.
Ключевые слова: эмбрионы, морула, бластомеры, бластоцисты, гонадотропин, трансплантация.
Введение
Воспроизводство животных – это основной фактор, лимитирующий эффективность производства животноводческих продуктов на промышленной основе. Причины, препятствующие достижению оптимальных результатов в воспроизводстве домашнего скота, различны. Новые методы расширяют возможности регулирования воспроизводства. Они связаны с манипулированием на уровне клеток или эмбрионов с использованием физиологически активных соединений, поэтому названы биотехнологическими. К числу этих методов относят: стимуляцию и синхронизацию охоты, суперовуляцию, искусственное осеменение, трансплантацию эмбрионов, хранение гамет и эмбрионов, целенаправленное получение двоен, регулирование пола, раннюю диагностику беременности, управление процессом родов, создание химер и др. [5].
Трансплантация эмбрионов в настоящее время является одной из наиболее актуальных проблем в области животноводства. С помощью пересадки эмбрионов можно резко увеличить выход числа потомков от высокопродуктивных коров. Трансплантация эмбрионов, или эмбриотехнология, заключается в получении одного или нескольких эмбрионов из матки племенных животных (доноров) и пересадке в матку рецепиентов. Этот метод в сочетании с суперовуляцией у доноров позволяет получить большое потомство от высокопродуктивных животных. Применение этого метода также упрощает обмен генофондом сельскохозяйственных животных между странами и континентами. Пересадка эмбрионов может быть использована для получения потомства от ценных, но бесплодных коров, утративших способность к размножению в результате несчастного случая, болезни или по возрасту [5, 4].
Материалы и методы
Исследования проводились в лаборатории Юго-Западного научно-исследовательского института животноводства и растениеводства.
Объектом исследований послужили овцематки – доноры.
Материалом исследования послужили эмбрионы, полученные от овцематок-доноров.
Извлечение эмбрионов у овец и коз проводят хирургическим методом. Перед извлечением маток выдерживают на голодной диете в течение 12 часов. Извлечение эмбрионов осуществляют под общей или местной анестезией. Для анестезии применяют полинаркон-5, комбелен, рампунь, новокаин.
При извлечении на 3-4 день цикла в яйцевод вводят тонкий катетер и закрепляют его при помощи зажима или лигатуры. Через прокол стенки матки на расстоянии 1 см от бифуркации вводят катетер Фоллея (с наружным диаметром 2 мм), надувают воздухом баллончик, фиксируя катетер в роге матки. В качестве среды для извлечения применяется фосфатно-солевой буфер (среда Дюльбекко) с добавлением 2% фетальной сыворотки. Сначала промывают яйцевод, вводя через катетер 3-6 см3 среды. Затем промывают матку, вводя среду Дюльбекко (10-25 см3) через иглу, вставленную в верхушку рога. На промывание одного рога матки используют 100-140 см3 среды. Промывную жидкость, извлеченную из матки через катетер Фоллея, переносят в фильтр для эмбрионов. Аналогично промывают второй рог матки донора.
При оценке жизнеспособности эмбрионов учитывают стадию развития эмбриона, состояние хронологического возраста, определяют морфологическое состояние. Исходя из этих критериев, устанавливается качество эмбриона и его пригодность для дальнейшего использования [10, 6].
Отличный или хороший (1) – эмбрион идеальный, сферический, симметричный, с клетками одного размера, цвета и плотности или имеет незначительные изъяны, такие, как несколько бластомеров, выделившихся из общей массы в перивителлиновое пространство, неправильная форма клеточной массы, несколько вакуолей, стадия соответствует возрасту;[2]
Удовлетворительный (2) – морфологическое строение имеет серьезные замечания; присутствие разрушенных бластомеров, сильная вакуолизация, неоднородное окрашивание, низкая плотность клеточной массы, наличие множества клеток в перивителлиновом пространстве, отставание развития до 24 часов [1, 2];
Плохой (3) – многочисленные вытесненные из общей массы бластомеры, нарушение межклеточных связей, дегенерированные клетки, клетки различного размера, много крупных вакуолей и гранул, отставание развития более 24 часов, частично разрушенная или деформированная зона пеллюцида [2].
Мертвый и/или дегенерировавший (4) – сильные разрушения клеточной массы, связь между бластомерами нарушена, бластомеры разных размеров, несоответствие хронологическому возрасту, сильная вакуолизация и грануляция, разрушена зона пеллюцида [10].
Стадия развития эмбрионов
Неоплодотворенная яйцеклетка (1) – имеет сферическую форму, окружена прозрачной оболочкой, диаметр составляет 0,14-0,17 мм. Между прозрачной оболочкой и плазматической частью находится перивителлиновое пространство, заполненное жидкостью.
2-12 – клеточная стадия (2) – имеет сферическую форму и от 2 до 12 клеток (бластомеров). Эмбрион имеет рыхлую структуру, между бластомерами нет прочных контактов.
Ранняя морула (3) – клеточная масса до 32 бластомеров, занимает большую часть перивителлинового пространства, отдельные клетки (бластомеры) хорошо различимы. Перивителлиновое пространство четко выражено. Размер – 0,14-0,17 мм.
Морула (4) – клеточная масса состоит из 33-64 бластомеров, занимает 60-70% перивителлинового пространства, бластомеры образуют компактную массу. Перивителлиновое пространство выражено четко. Размер – 0,14-0,17 мм.[2].
Ранняя бластоциста (5) – клеточная масса состоит из 65-130 бластомеров, занимает 70-80% перивителлинового пространства, в компактной массе бластомеров образуется небольшая наполненная жидкостью асимметрично расположенная полость (бластоцель). Эмбриобласт и трофобласт визуально еще плохо различимы. Перивителлиновое пространство выражено четко. Размер- 0,14-0,17 мм.[7].
Бластоциста (6) – клеточная масса состоит из 65-130 бластомеров, занимает большую часть перивителлинового пространства. Четко выражена дифференциация внешнего слоя трофобласта и более темной и компактной внутренней массы клеток (эмбриобласта). Бластоцель хорошо выражена, перивителлиновое пространство почти полностью вытеснено. Размер – 0,14-0,20 мм.
Расширенная бластоциста (7) – состоит из 131-200 клеток, внешний диаметр увеличивается в 1,2-1,5 раза. Перивителлиновое пространство полностью исчезает. Прозрачная оболочка растянута и утончена до 1-3 первоначальной величины. Трофобласт в виде уплощенной цепочки располагается непосредственно под прозрачной оболочкой. Эмбриобласт – в виде компактного скопления клеток. Размер – 0,18-0,22 мм. [7].
Статическая обработка экспериментальных данных проводилась по стандартным методикам на персональном компьютере [8].
Результаты исследований
Изучены и оценены стадии развития 356 эмбрионов полученных от овцематок-доноров, обработанных ГСЖК разного возраста и сроков жеребости. Из них эмбрионы полученные традиционным способом 141 шт, новым способом 215 шт.
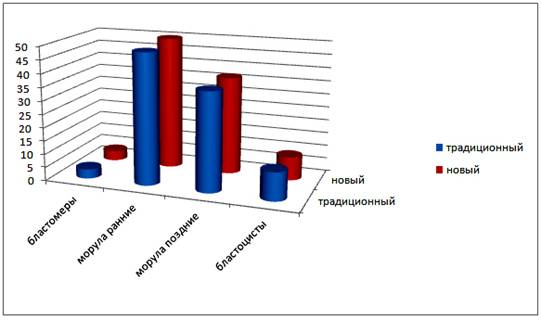
Диаграмма 1. Развитие эмбрионов у доноров.
В результате исследования не обнаружено существенного различия на стадиях развития эмбрионов у доноров, полученных при индукции суперовуляции разными препаратами.
Меньше всего эмбрионов получено на ранних стадиях развития (бластомеры 2-12 клеточные) и составило 3,5±1,5% и 3,7±1,2%; эмбрионы на стадии морулы ранние – 48,9±4,2% и 50,7±3,4; морулы поздние – 36,9±4,0% и 36,7±3,3%; эмбрионы на стадии бластоцисты – 10,6±2,6% и 8,8±1,9%.
В целом, стадия развития извлеченных из рог матки доноров были в основном морулы ранние и поздние, т.е. соответствуют возрасту эмбрионов.
Таким образом эмбрионы, полученные после обработки доноров разными препаратами по стадии развития недостоверными (Р<0,05).
Это указывают о несущественном влиянии использованных гонадотропинов на стадию развития эмбрионов.
Примерно такая же недостоверная тенденция по качеству эмбрионов наблюдается в группе доноров обработанных гонадотропинами, полученными из сыворотки крови жеребых кобыл с учетом и без учета возраста и сроков жеребости.
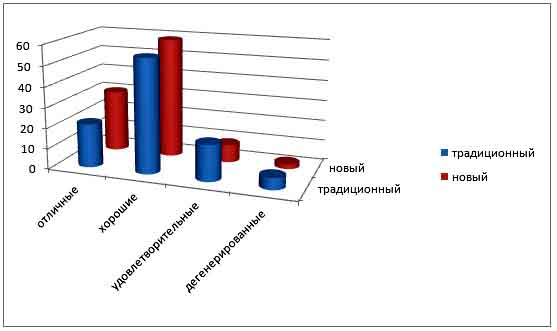
Диаграмма 2. Качество эмбрионов, полученных от доноров.
Идентификацию на основании морфологических признаков уровня развития и степени жизнеспособности эмбрионов проводили по шкале оценки качества: отличные эмбрионы, хорошие эмбрионы, удовлетворительные эмбрионы, дегенерированные эмбрионы.
Биологически полноценными считали зародыши, имеющие шарообразную форму, гомогенную цитоплазму, неповрежденную оболочку, одинакового размера бластомеры.
Исследования по морфологической оценке показали, из общего числа 356 эмбрионов отличного качества 95 эмбрионов (при традиционном способе 30 (21,3±3,4%), при новом способе 65,1 (30,3±3,9%), хорошего качества 204,1 (при традиционном способе 77,9 (55,3±4,2%), при новом способе 126,2 (58,7±4,1%), удовлетворительного качества 43,6 (при традиционном способе 24,9 (17,7±3,2%), при новом способе 18,7 (8,7±2,4), дегенерированного качества 12,9 (при традиционном способе 8 (5,7±1,9%), при новом способе 4,9 (2,3±1,2%).
Как видно из приведенных данных разница по качеству эмбрионов доноров между сравниваемыми способами незначительна и недостоверна (Р>0,05).
Выводы
Доноры, обработанные гонадотропинами, полученными традиционными и новыми технологическими методами, с целью вызывания суперовуляции отличались по реактивности яичников после гормональной обработки и по числу эмбрионов на донора.
Внедрение нового гонадотропного препарата, полученного из сыворотки крови кобыл-доноров с учетом возраста и сроков жеребости в технологии трансплантации эмбрионов, позволило увеличить число овуляции на донора, долю овцематок доноров с суперовуляцией на 20,0% и число эмбрионов на донора 1,5 раза.
В целом, результаты проведенных исследований указывают о высокой эффективности разработанного нового приема отбора жеребых кобыл в качестве продуцентов ГСЖК, позволяющего не только повысить выход гонадотропина с оптимальным преобладанием ФСГ из исходного сырья, но и способствующего индукции множественной овуляции и получению максимально большего количества полноценных эмбрионов.
Литература
1. Байтлесов Е.У. Биотехнологические методы интенсификации воспроизводства маточного стада в мясном скотоводстве. Саратов 2011.
2. Голубец Л.В. Оценка качества ооцитов и эмбрионов крупного рогатого скота, Гродно: ГГАУ, 2011.
3. Джамалова Г.А. Биотехнология животных.- Алматы 2004.-с 82-95.
4. Еремина М.А. Селекционно-генетические аспекты использования метода трансплантации эмбрионов в разведении молочного скота, Дубровицы, 2006.
5. Кузьмина Н. Биотехнология: суперовуляция, искусственное осеменение, трансплантация эмбрионов. 2013. www.biotechnolog.ru/acell/acell6_1.htm.
6. Мырзахметов Т. М., Оспанова Г. З. Роль биотехнологии в развитии животноводства. Алматы: НЦ НТИ, 2009. – с. 20-25.
7. Падучева А.Л., Бойко Д.Ф. Гормональные методы повышения плодовитости сельскохозяйственных животных. Москва 1965.
8. Плохинский Н.А. Алгоритмы биометрии. Москва 1980.
9. Cole H.H., FJ Saunders (Published Online: July 01, 2013). The concentration of gonad-stimulating hormone in blood serum and of oestrin in the urine throughout pregnancy in the mare. Endocrinology, vol. 19, issue 2 http://dx.doi.org/10.1210/endo-19-2-199.
10. Малиновский А.М., Решетникова Н.М., Мороз Т.А. Способ определения жизнеспособности эмбрионов (Патент RU 2155557).
Поступила в редакцию 21.08.2014 г.