Спектроскопическое исследование химических объектов методом ядерного магнитного резонанса (ЯМР-спектроскопия)
Кузьмич В. В.
доктор технических наук, профессор, зав. кафедрой БНТУ,
Козлов Н. Г.
доктор химических наук, доцент, зав. лабораторией органического катализа ИФОХ НАН Белпруси,
Почанин Ю. С.
кандидат технических наук, доцент, доцент кафедры БНТУ,
Карпунин И. И.
доктор технических наук, профессор, профессор кафедры БНТУ,
Балабанова О. В.
кандидат медицинских наук, доцент,
Клюев А. Ю,
ведущий научный сотрудник, канд. технических наук ИФОХ НАН Беларуси,
Латышевич И. А.
аспирантка ИФОХ НАН Беларуси.
Метод ЯМР выявляет информацию о молекулярном строении химических веществ, позволяет изучить динамические процессы в образце – определять константы скорости химических реакций, величину энергетических барьеров внутримолекулярного вращения. Все исследуемые образцы канифолей растворяли в CDCl3 (10%). CDCl3-дейтериохлороформ для растворения соединений для ЯРМ-спектроскопии. Спектры записывали на ЯМР спектрометре AVANCE–500 (500 МГц для ядер 1Н и 125 МГц – для 13С), рис. 1.

Рис. 1. ЯМР - спектрометр AVANCE-500.
Химические сдвиги сигналов протонов соединений определяли по сигналу хлороформа (d = 7,27 м.д., примесь), а химические сдвиги 13С измеряли относительно сигнала растворителя (d = 77,7 м.д.). Для идентификации и количественного определения содержания СК были записаны спектры индивидуальных кислот: абиетиновой (1), дегидроабиетиновой (2), изопимаровой (3), левопимаровой (4), неоабиетиновой (5), палюстровой (6) и пимаровой (7). Кроме того, были записаны спектры растворов в CDCl3 композиций названных канифолей, обработанных 30 % диэтилентриамином.
На рис. 1а показан спектр 1Н ЯМР сосновой живичной канифоли, состоящий из областей поглощения ароматических, олефиновых и алифатических протонов. Видно, что наиболее удобны для анализа первые две области (рис. 1б). Цифрами обозначены линии, принадлежащие соответствующим СК.
Были записаны спектры растворов в CDCl3 композиций названных канифолей, обработанных 30 % диэтилентриамином. На рис. .2а показан спектр 1Н ЯМР сосновой живичной канифоли, состоящий из областей поглощения ароматических, олефиновых и алифатических протонов. Видно, что наиболее удобны для анализа первые две области (рис. 2б). Цифрами обозначены линии, принадлежащие соответствующим СК.
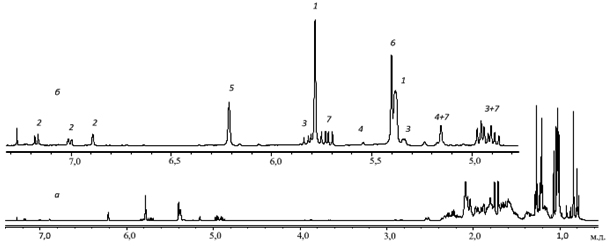
Рис. 2. 1Н ЯМР спектр раствора сосновой живичной канифоли в CDCl3: а – полный спектр, б – область ароматических и олефиновых протонов.
Рисунок 3а отображает 13С ЯМР спектр этого же образца. Поскольку все линии практически индивидуальны, для анализа можно использовать весь спектр, но наиболее удобна область поглощения ароматических и олефиновых углеродов (рис. 3б). Здесь, как и на рис. 2б, цифрами обозначены линии поглощения соответствующих СК.
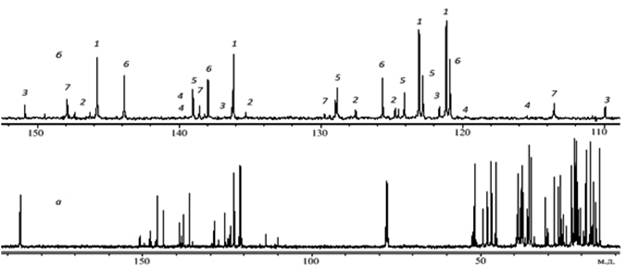
Рис. 3. 13С ЯМР спектр раствора сосновой живичной канифоли в CDCl3: а – полный спектр, б – область ароматических и олефиновых углеродов.
На рисунке 4а показан 1Н ЯМР спектр диспропорционированной канифоли (область ароматических и олефиновых протонов). Цифрами обозначены линии, принадлежащие протонам соответствующих кислот.
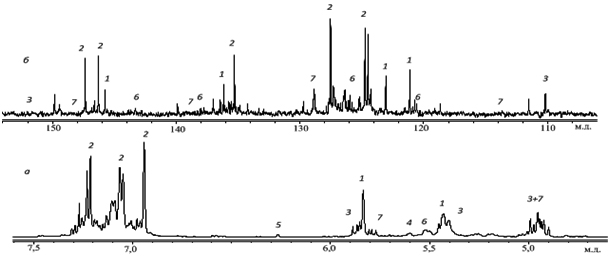
Рис. 4. ЯМР спектр раствора диспропорционированной канифоли в CDCl3 (область ароматических и олефиновых сигналов): а – 1Н, б – 13С.
Результаты количественного анализа состава исследованных образцов канифолей представлены в табл. 1.
Таблица. 1.
Состав канифолей.
|
Состав, % |
СЖК |
ДЖК |
|
Абиетиновая кислота (1) |
34,5 |
3,2 |
|
Дегидроабиетиновая кислота (2) |
3,1 |
79,8 |
|
Изопимаровая кислота (3) |
5,4 |
5,3 |
|
Левопимаровая кислота (4) |
1,4 |
0,5 |
|
Неоабиетиновая кислота (5) |
16,2 |
0,1 |
|
Палюстровая кислота (6) |
24,1 |
2,1 |
|
Пимаровая кислота (7) |
9,2 |
4,3 |
Фунгитоксичность биоцидных добавок на основе канифоли к плесневым грибам
Для определения фунгицидной активности полученных продуктов была проведена экспресс-оценка способности вакуумного дистиллята ВД-2 с растворенными в нем фунгицидными добавками противостоять поражению образцов плесневыми грибами . Испытуемые образцы размером 30×20×2 мм изготавливали из полиэтилена, на 1 мин помещали в расплавы ВД-2 с 20 % антисептических добавок.
Фунгитоксичность образцов по отношению к плесневым грибам оценивали методом «агаровой сетки» питательной среды Чапека-Докса, инокулированной спорами гриба Aspergillusniger (А.niger), отличающегося повышенной устойчивостью к действию антисептиков. Эта питательная среда является полусинтетической средой с нитратом натрия в качестве источника азота, ее используют для культивирования грибов. Чашки инкубировали при температуре 28°C в течение 8 сут., ячейки агаровой сетки ежедневно переносили на предметные стекла и микроскопировали в проходящем свете. Критерием фунгитоксичности служила лаг-фаза, т.е. время от постановки опыта до начала прорастания спор.Если лаг-фаза у образцов составляла более 8 суток, то считалось, что образцы на фунгитоксичность выдержали испытания .
В табл. 2 приведены данные Прорастание спор гриба Aspergillusniger на агаровой сетке среды Чапека-Докса, нанесенной на образцы, обработанные дистиллятом ВД-2 с 20,0 мас.% фунгицидных добавок канифоли (СЖК и ДЖК), полученные химическим модифицированием ДЭТА.
Таблица 2.
Прорастание спор гриба Aspergillusniger на агаровой сетке среды Чапека-Докса.
|
Образец |
Прорастание спор гриба* |
Лаг-фаза, сут |
|||
|
1 сут |
2 сут |
3 сут |
8 сут |
||
|
СЖК |
– |
– |
– |
– |
> 8 |
|
ДЖК |
– |
– |
– |
– |
> 8 |
Примечание: * нет роста.
Грибостойкость пропитанных образцов пряжи оценивали в соответствии с ГОСТ 9.048 [1], метод 4 по степени развития плесневых грибов в условиях, имитирующих минеральное и органическое загрязнение. Образцы были опрысканы суспензией спор грибов Alternariaalternata, Aspergilluscarbonarius, Aspergillusniger, в среде Чапека-Докса и помещены в эксикаторы, на дне которых налита вода. Эксикаторы находились в сухо-воздушном термостате при температуре 28°C.Через 15 и 30 суток инкубации образцы осматривали под микроскопом в отраженном свете при увеличении в 60 раз при освещенности 200 люкс. Грибостойкость оценивали по интенсивности развития грибов в соответствии с ГОСТ 9.048 [2] по баллам: 0 – под микроскопом прорастания спор и конидий не обнаруживается; 1 – под микроскопом видны проросшие споры и незначительно развитый мицелий; 2 – под микроскопом виден развитый мицелий, возможно спороношение; 3 – невооруженным глазом мицелий и спороношение едва видны, но отчетливо видны под микроскопом; 4 – невооруженным глазом отчетливо видно развитие грибов, покрывающих менее 25% испытуемой поверхности; 5 – невооруженным глазом отчетливо видно развитие грибов, покрывающих более 25% испытуемой поверхности.
Далее на основе канифолей (СЖК и ДЖК), химически модифицированных ДЭТА, были приготовлены пропиточные составы для защиты древесины, рецептуры которых приведены в табл. 3.
Таблица 3.
Рецептуры пропиточных составов и результаты испытаний пропитанных образцов древесины на устойчивость к воздействию плесневых, грибов.
|
№ рецептуры |
Фунгицидная добавка, мас.% |
Пленкообразующий компонент – алкилфенолформальдегидная смола), мас.% |
Растворитель, мас.% |
Грибостойкость*** |
Потеря массы****, мас.% |
|
|
Площадь поражения, % |
Стадия развития грибов, баллы |
|||||
|
9–20* |
20 |
30 |
50 |
10 |
1 |
3,1 |
|
9–25* |
25 |
25 |
50 |
0 |
0 |
2,8 |
|
9–30* |
30 |
20 |
50 |
0 |
0 |
2,0 |
|
10–20** |
20 |
30 |
50 |
15 |
2 |
3,6 |
|
10–25** |
25 |
25 |
50 |
0 |
0 |
2,5 |
|
10–30** |
30 |
20 |
50 |
0 |
0 |
1,8 |
|
Контроль |
100 |
5 |
48,1 |
|||
* – в рецептуре использована в качестве фунгицидной добавки СЖК, модифицированная ДЭТА; ** – в рецептуре использована в качестве фунгицидной добавки ДЖК, модифицированная ДЭТА.
Содержание фунгицидных добавок варьировали от 20 до 30 мас.%. В качестве пленкообразующих компонентов использовалась алкилфенолформальдегидная смола, а в качестве растворителя – скипидар.
Биозащитные свойства составов по отношению к плесневым и деревоокрашивающим грибам испытывали в соответствии с ГОСТ 30028.4-2006 «Средства защитные для древесины, экспресс-метод оценки эффективности против деревоокрашивающих и плесневых грибов» [3]. Образцы древесины сосны размером 10×55×75 мм с покрытием испытывали грибе Aspergillusniger.. Образцы выдерживали во влажной камере при относительной влажности 87–90% и температуре 26°C. Контролем служили образцы непропитанной древесины. Площадь поражения поверхности образцов при осмотре под микроскопом в отраженном свете при увеличении в 200 раз оценивали визуально через 5, 10 и 15 суток инкубации.
По окончании испытаний определяли стадию развития грибов по 5-бальной шкале и с учетом характеристик, обозначенных в ГОСТ 30028.4-2006 (0 – абсолютно чистые образцы при визуальном осмотре и под микроскопом; 1 – визуально чистые образцы, при осмотре под микроскопом видны мелкие очаги в виде одного вида гриба, стадия спороношения отсутствует; 2 – поверхностное развитие мицелия отдельных видов грибов, стадия спороношения отсутствует;3 – обильное разрастание мицелия отдельных видов грибов, начало стадии спороношения одного из видов; 4 – отчетливо виден рост грибов при визуальном осмотре, различные стадии спороношения большинства видов; 5 – глубокое поражение по всей площади образца, интенсивное спороношение).
Как видно из данных табл.3, составы 9–25, 9–30, 10–25, 10–30 полностью подавляют рост плесневых грибов, а оптимальное соотношение в пропиточных составах модифицированной канифоли составляет 25–30 мас.%.
Таким образом,.бактерицидные компоненты бактерицидного материала, в котором упакованы любые продукты питания или медицинские средства, препятствуют процессу развития микроорганизмов и бактерий. При этом активным веществом биоцидных композиций являются некоторые органические вещества растительного происхождения.
Литература
1. Разработка рецептуры и технологии получения антисептического состава для защиты древесины на основе лесохимического и растительного сырья : отчет о НИР (заключ.) / Институт химии новых материалов НАН Беларуси. Минск, 2007. 56 с. № ГР 2006899.
2. Крутяков, Ю.А., Артемов, А.В., Оленин, А.Ю., Иванов, М.Н., Шеляков, О.В. Получение бактерицидных пленок полиэтилентерефталата, модифицированных наночастицами серебра// Российские нанотехнологии. 2008, том 3, № 11-12, с 171-176.
3. Новиков, В. И Упаковочный материал для металлопродукции / В. И. Новиков // Всес. научн.-исслед. проект.-конструкт. и технол. ин-т кабел. пром-сти. – №4099585/24-12, (114061). 2012.
Поступила в редакцию 08.02.2017 г.