Влияние менопаузальной гормональной терапии на молочные железы
Троханова Ольга Валентиновна,
доктор медицинских наук, профессор кафедры акушерства и гинекологии Ярославского государственного медицинского университета Министерства здравоохранения Российской Федерации,
Чижова Юлия Анатольевна,
кандидат медицинских наук, ассистент кафедры акушерства и гинекологии Ярославского государственного медицинского университета Министерства здравоохранения Российской Федерации,
Сутугина Ольга Николаевна
ассистент кафедры акушерства и гинекологии Ярославского государственного медицинского университета Министерства здравоохранения Российской Федерации,
Абдуллаева Ханум Гахрамановна,
врач акушер-гинеколог ГБУЗ ЯО «Областной перинатальный центр».
The influence of menopausal hormone therapy on the breast
O.V. Trokhanova, Y.A. Chijova, O.N. Sutugina, H.G. Abdullaeva.
Введение
Общая стратегия поддержания здоровья женщин в пери- и постменопаузе, наряду с обязательным соблюдением здорового образа жизни, включает менопаузальную гормональную терапию (МГТ). Цель ее назначения – частично восполнить дефицит половых гормонов, используя такие минимально-оптимальные дозы гормональных препаратов, которые способны реально улучшить общее состояние больных, обеспечить профилактику поздних обменных нарушений и не сопровождаются побочными эффектами. Однако, на протяжении многих лет встает вопрос о влиянии используемых препаратов на различные системы и органы женщины, в том числе, актуальным остается вопрос о влиянии на состояние молочной железы.
Изменение гормонального равновесия перименопаузального периода вызывает морфофункциональную перестройку молочных желез, но, у одних женщин эти изменения могут не выходить за рамки физиологических вариантов, а у других, при условии активации рецепторного аппарата желез, способны перейти в патологическую стадию. До настоящего времени происходит обсуждение вопроса, какое влияние оказывают препараты МГТ на молочные железы и каков риск возникновения рака молочной железы (РМЖ) после их использования. Однозначного ответа до сих пор не получено, что и неудивительно с учетом мультифакториальной природы РМЖ и многочисленных модификаций МГТ (самих препаратов, доз, схем, длительности лечения), предложенных за эти годы. Как пример, результаты некоторых исследований:
· Исследование здоровья медсестер (Nurses’ Health Study,1995 г.) выявило: относительный риск (ОР) = 1.14, 1.20, 1.46 при приеме МГТ < 2-х, 5-и и 10-и лет соответственно [4].
· В обзоре, опубликованном в 1996 году группой по изучению Гормональных Факторов Рака Молочной Железы (HFBC), было отмечено незначительное увеличение риска развития рака молочной железы (1,2-1,3) при использовании препаратов МГТ [4].
· В 1997 г. были опубликованы коллективно пересмотренные результаты 51-го эпидемиологического исследования и данные о 161 116 женщинах. Главный вывод: риск обнаружения РМЖ повышен при долгосрочной МГТ (1.35), по прекращении лечения риск возвращается к исходному [6].
· В 1999 г.- кратковременная (до 5 лет) ЗГТ — монотерапия эстрогенами или комбинированная терапия эстрогеном в сочетании с неандрогенным прогестагеном — не повышает риска РМЖ у здоровых женщин. Долгосрочная ЗГТ (в течение 10—15 лет) может быть сопряжена с повышенным риском, но эпидемиологические методы недостаточно точны, чтобы судить о случайности или не случайности этой связи [4, 7].
· Исследование заместительной эстрогенной терапии «Инициатива во имя здоровья женщин», (WHI ERT, 2004 г.) отметило снижение ОР до 0,77 [8].
· Крупное французское проспективное когортное исследование (E3N Cohort Study, 2008 г., на основании наблюдения 59 216 женщин в течение 8 лет, показало, что при использовании микронизированного прогестерона и дидрогестерона в составе комбинированной МГТ риск РМЖ не повышается. При использовании других прогестагенов в этом исследовании отмечено некоторое повышение риска РМЖ. Это доказывает, что риск РМЖ зависит от выбора гестагеннного компонента [4, 9].
• Результаты DOPS показали, что при использовании комбинированной МГТ (эстрадиол + норэтистерона ацетат) в течение 10 лет у женщин в пери- и в ранней постменопаузе не повышался риск РМЖ [4].
• В EURAS-HRT на фоне комбинации эстрадиол + дроспиренон выявлена отчетливая тенденция к снижению частоты РМЖ (скорректированный ОР 0,7) по сравнению с другими комбинированными режимами МГТ [4, 7].
• Большой метаанализ 67 370 женщин в наблюдательном исследовании показал, что риск РМЖ не повышается при приеме МГТ менее 5 лет [4].
С учетом неоднозначных выводов, многие гинекологи, занимающиеся вопросами лечения климактерического периода, с опасением назначают препараты МГТ из-за боязни негативного влияния на молочные железы. Причина этого – отсутствие объективного метода оценки молочных желез для осуществления динамического наблюдения при использовании гормональных препаратов. Приведенные данные в современной литературе об изменениях в молочных железах на фоне использования препаратов МГТ базируются на оценке жалоб пациенток, данных УЗИ, рентгенологической маммографии, цитологического и гистологического исследований. Ценность каждого из перечисленных методов диагностики несомненна и многократно доказана, но для проведения динамического наблюдения за состоянием молочных желез преимущество имеет метод электроимпедансного томографического исследования (ЭИТ). Это связано с реальной возможностью обнаружения минимальных изменений в молочных железах по данным ЭИМ и способностью метода дать не только визуальную, но и количественную объективную оценки состояния молочных желез.
Цель нашего исследования – оценить состояние молочных желез при приеме МГТ при помощи метода электроимпедансного томографического исследования.
Материалы и методы исследования
В исследовании приняли участие 323 женщины от 45 до 63 лет, которые составили 3 клинические группы:
1 группа (контроля): 88 женщин (42 пациентки 45-51 года и 46 пациенток 52-63 лет), которые на момент исследования не принимали препараты МГТ.
2 группа: 162 женщины, принимающие на момент исследования препараты МГТ более 2-х лет (111 пациенток 45-51 года и 51 пациентка 52-63 лет).
3 группа: 73 женщины, у которых после последнего приема МГТ прошло более 3-х лет (41 пациентка 45-51 года и 32 пациентки 52-63 лет).
Критерии включения женщин в исследование:
· Отсутствие патологии молочных желез. Выполнение этого условия позволило выявить возможные минимальные изменения в молочной железе при приеме препаратов МГТ.
· Прием: эстрадиол 1 мг + дидрогестерон 10 мг или эстрадиол 2 мг + дидрогестерон 10 мг (женщины 45-51 года) или эстрадиол 1 мг + дидрогестерон 5 мг (женщины 52-63 лет) более 2-х лет (при соблюдении рекомендаций по назначению препаратов).
· Прием: эстрадиол 1 мг + дидрогестерон 10 мг или эстрадиол 2 мг + дидрогестерон 10 мг (женщины 45-51 года) или эстрадиол 1 мг + дидрогестерон 5 мг (женщины 52-63 лет) в анамнезе (интервал после последнего приема более 3-х лет).
Использовались следующие методы диагностики:
· Общеклинические методы обследования молочных желез (сбор анамнеза, осмотр, пальпация).
· Ультразвуковое исследование молочных желез.
· Рентгенологическая маммография.
· Электроимпедансная маммография проводилась всем пациенткам при помощи многочастотного 256-электродного электроимпедансного маммографа (МЭМ), разработанного институтом радиотехники и электроники РАН, на частотах 10 кГц и 50 кГц (ТУ 9442-002-71188036-2008. Сертификат соответствия № РОСС RU.ИМ04 ВО6814. Регистрационное удостоверение № ФСР 2008/02744). Измерительная система и алгоритм реконструирования изображений позволяют, используя набор 256 электродов, располагающихся в виде двумерной матрицы на плоской поверхности, визуализировать статические распределения электропроводности среды, прилегающей к поверхности с электродами. Ток, протекая через ткани молочной железы, создает объемное распределение электрического потенциала. Потенциал уменьшается вдоль линии тока по мере удаления от инжектирующего ток электрода. Падение напряжения на единицу длины пропорционально величине тока I и сопротивлению среды DR в соответствии с законом Ома. Измеряя падение напряжения DV и зная ток, можно вычислить величину сопротивления. Во время обследования матрица прижимается к молочной железе в направлении ребер, а два отводящих электрода, один из которых используется как общий электрод источника тока, а второй – как опорный электрод измерителя разности потенциалов, состыкованы между собой и располагаются на запястье пациентки. Измеритель разности потенциалов подключается мультиплексором к первому электроду матрицы, а затем источник тока последовательно подключается к каждому из оставшихся электродов матрицы и производятся измерения. После этого цикл повторяется для другого регистрирующего электрода. Полный набор данных, используемых для получения изображения, состоит из 65280 результатов измерений. Обработка материала осуществляется с помощью персонального компьютера, соединенного с прибором через стандартный USB-порт. Результатом реконструирования являются электроимпедансные изображения семи поперечных сечений исследуемой среды, параллельных плоскости с электродами, взятых с шагом 0.7 см по глубине. На каждой плоскости можно оценить показатели электропроводности, которые будут меняться при малейших структурных изменениях ткани [1, 2, 3].
· Для статистической обработки полученных данных использовали пакет прикладных программ STATISTICA 10. Проводилось вычисление среднего показателя (М) и стандартного отклонения (SD). При наличии нормального распределения оценка достоверности различий проводилась по t-критерию Стьюдента. В качестве доверительной использовали вероятность p=0,05.
Результаты исследования
Все исследования проводились на 5-9 день от начала кровянистых выделений при применении эстрадиола 1 мг + дидрогестерона 10 мг или эстрадиола 2 мг + дидрогестерона 10 мг и по мере обращения при использовании эстрадиола 1 мг + дидрогестерона 5 мг и у женщин постменопаузального периода. Перед проведением ЭИТ всем женщинам проводилось обследование молочных желез традиционными методами (общеклинические, УЗИ, рентгеномаммография) для исключения патологии.
Опыт многолетней работы [5] показал, что статистически достоверной разницы в показателях электропроводности в зависимости от позиции при исследовании (лежа – стоя) и стороны сканирования (правая – левая молочные железы) нет. Закономерности изменения показателей электропроводности одинаковые на всех уровнях соответственно. Поэтому, для наибольшей наглядности мы использовали средние значения электропроводности со 2 уровня сканирования (глубины 1,1 см). Кроме того, с учетом анатомического строения на этой глубине возможно нахождение всех тканей и структур молочной железы. В таблицах 1 и 2 представлены полученные результаты. Электропроводность выражается в условных единицах.
Таблица 1.
Показатели электропроводности молочных желез в различных клинических группах. 50 кГц. 2 уровень сканирования. (М±SD).
|
Группы
Возраст |
1 группа |
2 группа |
3 группа |
||
|
Без МГТ |
Э 1 мг + Д 10 мг Э 2 мг + Д 10 мг |
Э 1 мг + Д 5 мг |
Э 1 мг + Д 10 мг Э 2 мг + Д 10 мг |
Э 1 мг + Д 5 мг |
|
|
45-51 года |
0,53±0,03 n=42 |
0,54±0,01 n=111 |
|
0,53±0,02 n=41 |
|
|
52-63 года |
0,56±0,05 n=46 |
|
0,55±0,04 n=51 |
|
0,56±0,04 n=32 |
Примечание: Э – эстрадиол. Д – дидрогестерон.
Таблица 2
Показатели электропроводности молочных желез в различных клинических группах. 10 кГц. 2 уровень сканирования. (М±SD).
|
Группы
Возраст |
1 группа |
2 группа |
3 группа |
||
|
Без МГТ |
Э 1 мг + Д 10 мг Э 2 мг + Д 10 мг |
Э 1 мг + Д 5 мг |
Э 1 мг + Д 10 мг Э 2 мг + Д 10 мг |
Э 1 мг + Д 5 мг |
|
|
45-51 года |
0,48±0,02 n=42 |
0,48±0,03 n=111 |
|
0,49±0,03 n=41 |
|
|
52-63 года |
0,51±0,05 n=46 |
|
0,50±0,05 n=51 |
|
0,51±0,04 n=32 |
Примечание: Э – эстрадиол. Д – дидрогестерон.
Проведя сравнительный анализ полученных результатов, мы не получили статистически достоверной разницы между показателями электропроводности молочных желез у женщин, которые принимали более 2 лет эстрадиол 1 мг + дидрогестерон 10 мг, эстрадиол 2 мг + дидрогестерон 10 мг и эстрадиол 1 мг + дидрогестерон 5 мг, а, так же у женщин, с момента приема аналогичных препаратов у которых прошло более 3-х лет, по сравнению с группой контроля. Во всех случаях p>0,05 (на обеих частотах сканирования). Рис. 1.
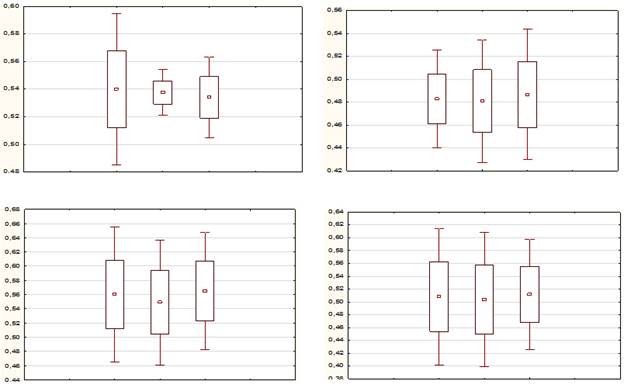
Рис. 1. Верхний левый рисунок: 45-51 год, 50 кГц. Верхний правый рисунок: 45-51 год, 10 кГц. Нижний левый рисунок: 52-63 года, 50 кГц. Нижний правый рисунок: 52-63 года, 10 кГц. На всех рисунках: 1, 2, 3 клинические группы слева-направо.
Биологическая ткань состоит из клеток и межклеточного пространства, заполненного веществом-электролитом. Внутреннее содержимое клетки отделено от межклеточного пространства мембраной, эквивалентная электрическая схема которой представляет собой параллельное соединение сопротивления и ёмкости. Поэтому, электропроводность биологических тканей зависит от частоты проходящего тока и формы его колебаний. Некоторые биологические ткани способны отвечать возбуждением на проходящий ток; в этом случае их электропроводность нелинейно зависит от амплитуды тока. Если возбуждения не возникает, то токи распространяются в ткани в соответствии с импедансом его компонентов. Клеточные мембраны представляют относительно большое сопротивление для токов низкой частоты, поэтому их основная часть проходит по межклеточным щелям. Амплитуда низкочастотных токов пропорциональна объёму межклеточного пространства (например, просвету кровеносных сосудов) и концентрации электролитов в нём. Измерение электропроводности биологических тканей на таких низких частотах используют в биологии и медицине для определения кровенаполнения различных органов, выявления отёка органов, в которых набухшие клетки уменьшают межклеточное пространство. Электропроводность биологических тканей, измеренная на больших частотах, пропорциональна общему количеству электролитов, содержащихся в ткани между электродами, т. к. в этом случае клеточные мембраны уже не препятствуют распространению электрического тока. Поэтому при использовании тока высокой частоты можно оценить клеточные структурные изменения по изменению показателей электропроводности [5].
Отсутствие изменений в показателях электропроводности между клиническими группами при исследовании на частоте сканирования 50 кГц, доказывает отсутствие структурных изменений в тканях молочной железы у женщин, принимающих или принимавших ранее препараты МГТ.
Отсутствие изменений в показателях электропроводности между клиническими группами при исследовании на частоте сканирования 10 кГц, доказывает отсутствие отека ткани молочной железы у женщин, принимающих или принимавших ранее препараты МГТ.
Заключение
В заключении Глобального консенсуса по МГТ [7] сказано: МГТ не является фактором риска рака молочной железы по сравнению с другими факторами (возраст старше 45 лет, избыточный вес, повышенный уровень холестерина и др.); МГТ продолжительностью до 5 лет не оказывает влияния на риск рака молочной железы. Наше исследование не выявило изменений в показателях электропроводности молочных желез у женщин, принимающих более 2 лет эстрадиол 1 мг + дидрогестерон 10 мг, эстрадиол 2 мг + дидрогестерон 10 мг и эстрадиол 1 мг + дидрогестерон 5 мг, а, так же у женщин, с момента приема аналогичных препаратов у которых прошло более 3-х лет, по сравнению с группой контроля, т.е. с показателями электропроводности неизмененных молочных желез у женщин, никогда не принимавших препараты МГТ. Это доказывает отсутствие негативного влияния препаратов МГТ на молочные железы при динамическом наблюдении.
Литература
1. Корженевский А.В., Корниенко В.Н., Культиасов Ю.С. и др. Электроимпедансный компьютерный томограф для медицинских приложений // Приборы и техника эксперимента. - 1997. - № 3. - С. 133-140.
2. Корженевский А.В., Карпов А.Ю., Корниенко В.Н. и др. Электроимпедансная томографическая система для трехмерной визуализации тканей молочной железы // Биомедицинские технологии и радиоэлектроника. - 2003. - № 8. - С. 5-10.
3. Корженевский. А.В. Квазистатическая электромагнитная томография для биомедицины: Дис. …д-ра. физ-мат. наук. - Москва, 2009. - 326 с.
4. Сметник В.П. и соавт. Менопаузальная гормональная терапия и сохранение здоровья женщины зрелого возраста // Кклимактерий. – 2014. - № 4. - 34 с.
5. Троханова О.В. Ранняя дифференциальная диагностика дисгормональных заболеваний молочных желез и контроль за эффективностью проводимого лечения при помощи электроимпедансных технологий: Дис. …д-ра. мед. наук. - Ярославль, 2010. - 319 с.
6. Collaborative Group on Hormonal Factors in Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52 705 women with breast cancer and 108 411 women without breast cancer. Lancet. – 1997. – Vol.350. – P.1047 - 1059.
7. De Villiers TJ, Gass ML , Haines CJ, et al . Global Consensus Statement on Menopausal Hormone Therapy // Climacteric. - 2013. – P. 203 – 204.
8. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. The Women’s Health Initiative randomized controlled trial. The Women’s Health Initiative steering committee // JAMA. – 2004. - 291:1701 – 1712.
9. Fournier A et al. Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study // Breast Cancer Res Treat. – 2008. - 107:103 –111.
Поступила в редакцию 16.10.2017 г.